Лечение простатита женскими гормонами
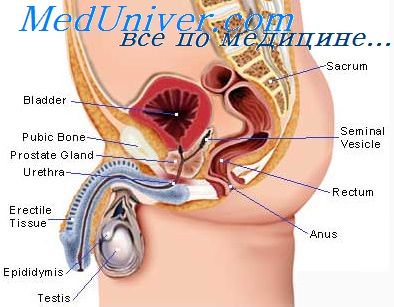
Рост предстательной железы. Влияние эстрогенов на простату
Следовательно, стероидные гормоны повышают интенсивность ДНК-зависимой РНК-полимеразной реакции в предстательной железе и являются пусковым фактором, обеспечивающим усиление биосинтеза белковых ферментов, от которых зависит соотношение компонентов секрета предстательной железы. Это в свою очередь обеспечивает дыхание, движение и жизнедеятельность сперматозоонов.
Различные андрогены вызывают рост предстательной железы, превращаясь в ДГТ. Не только натуральные, но и синтетические андрогены (например, тестостерона пропионат) опосредованно действуют через ДГТ.
Приведенные выше данные дают основание считать ДГТ активной формой тестостерона (Mainwaring, 1970; Schubert, 1972; Gigon, 1973).
Для функциональной активности предстательной железы большое значение имеют также, эстрогены.
Пути проникновения эстрогенов в клетки предстательной железы мало изучены. Однако известно, что эстрадиол связывается с цитоплазматическими протеинами предстательной железы (Unhjem, 1970). Рецепторы к эстрогенам обнаружены в предстательной железе свиньи, теленка (Gungblut, 1974), человека (Wagner, 1975; Hawkins, 1975) и крысы (Armstrong и Bashirelahi, 1978).
Эстрогены (как эндогенные, так и экзогенные) влияют на функции предстательной железы. Под влиянием эстрадиола бензоата повышается активность щелочной фосфатазы в вентральной предстательной железе крыс и аргиназ в дорсолатеральной (Jamaпака и соавт., 1975). При введении эстрогенов угнетается активность мальтазы в предстательной железе (Gunaga и соавт., 1970), значительно тормозится зависимая от тестостерона секреция фруктозы (Thomas и Knych, 1966). Аналоги стильбэстрола подавляют синтез тестостерона, активность ферментов андрогенного метаболизма в предстательной железе, в частности, тестостерон-17-20-лиазы (Danutra и соавт., 1973). Под влиянием эстрогенов снижается секреторная активность предстательной железы, а спустя 2 нед после начала инъекций прекращается совсем (Leav и соавт., 1971; Hoissaeter, 1975).

Концентрация плазменного тестостерона достоверно снижалась уже через 24 ч после инъекции экстрадиола бензоата, а в яичках обнаруживались только его следы (Chowdhury, 1974).
При введении эстрогенов резко подавляется активность 5а-редуктазы (Shimazaki и соавт., 1972; Moore и соавт., 1973). Путь обмена тестостерона изменяется на окислительный с преимущественным образованием андростендиона (Leav и соавт., 1971).
Под влиянием длительного введения эстрогенов полностью тормозятся метаболизм тестостерона в предстательной железе и связанные с ним физиологические эффекты. При этом атрофии подвергается лишь кортикальная (андрогенозависимая) часть предстательной железы. В мозговой (эстрогенозависимой) зоне после введения эстрогенов наблюдается пролиферация соединительной и гладкомышечной ткани.
По мнению Л. М. Шабад (1949), Chierego и соавторов (1957), присутствие андрогенов необходимо для функционирования клеток железистого эпителия и миоэпителиальных элементов предстательной железы. На развитие же соединительной фиброзной ткани мужские половые гормоны не влияют. Возможно, андрогены стимулируют-эпителий дополнительных органов размножения, в то время как эстрогены вызывают в этих органах увеличение мышечной ткани.
Специфическое связывание эстрогенов в добавочных органах репродуктивной системы человека и многих видов млекопитающих отмечали Armstrong и соавторы (1973), Rennie и Bruchovsky (1973), Bashirebahi и Armstrong (1974), Varkarakis и соавторы (1975).
Ferland и соавторы (1976) показали, что относительно высокие дозы эстрогенов могут тормозить секрецию обоих гонадотропинов. Причем это влияние осуществляется на уровне гипоталамуса. Авторы отмечают, что эстрогены в зависимости от дозы могут стимулировать или тормозить секрецию люлиберина. Эстрогены повышают чувствительность ответной реакции лютропина на люлиберин.
– Также рекомендуем “Влияние прогестерона на простату. Нейроэндокринная регуляция предстательной железы”
Оглавление темы “Физиология предстательной железы”:
1. Предстательная железа. Морфология предстательной железы
2. Развитие предстательной железы. Строение простаты
3. Кровоснабжение предстательной железы. Лимфоотток от простаты
4. Функции предстательной железы. Секрет простаты
5. Состав секрета простаты. Обмен андрогенов в предстательной железе
6. Метаболизм гормонов в простате. Обмен тестостерона в предстательной железе
7. Изучение обмена андрогенов в простате. Обмен тестостерона у млекопитающих
8. Влияние гормонов яичек на простату. Воздействие стероидов на предстательную железу
9. Рост предстательной железы. Влияние эстрогенов на простату
10. Влияние прогестерона на простату. Нейроэндокринная регуляция предстательной железы
Источник
Признаки и лечение синдрома тестикулярной феминизации
Причины заболевания
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для лечения щитовидки наши читатели успешно используют Монастырский чай. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Заболевание имеет рецессивный Х-сцепленный тип наследования и обеспечивается мутацией гена, кодирующего рецептор андрогенов. Женщины являются его носителями без каких-либо патологических проявлений.
Мальчик, имеющий мужской генотип и гонады, секретирующие тестостерон, не может полноценно развиваться из-за того, что периферические ткани нечувствительны к андрогенам, их эффекты не могут реализоваться. Восприимчивость к эстрогенам сохранена, что обуславливает возможность развития женских вторичных половых признаков. От степени выраженности нечувствительности рецепторов к андрогенам зависит уровень фенотипических отклонений.
Формы, клиническая картина
Различают полную и неполную формы заболевания, которые имеют разную степень выраженности симптомов.
Первая разновидность синдрома тестикулярной феминизации характеризуется наличием мужских генотипа и гонад, но женского фенотипа, в том числе наружных половых органов. При рождении констатируется женский пол ребенка. До достижения пубертатного периода развитие такой девочки происходит нормально. В возрасте полового созревания отмечается появление выраженных вторичных женских половых признаков (грудь, округлые бедра), сочетающееся с отсутствием менструаций (первичная аменорея ). Это заставляет обратиться родителей за медицинской помощью, а в ходе обследования выясняется, что ребенок генотипически является мальчиком. Иногда диагноз ставят раньше в связи с операцией по поводу паховой грыжи при обнаружении яичек в грыжевом мешке. Матка при этом заболевании отсутствует, влагалище укорочено и оканчивается слепо, яички расположены чаще всего в больших половых губах, паховых каналах или брюшной полости. У пациентов выражено половое влечение.
Большинство здоровых женщин имеют нежелательные волосы на теле: на ногах, руках, над верхней губой. Эти признаки являются эффектом воздействия андрогенов, которые образуются и в женском организме. У мужчин с полной формой синдрома тестикулярной феминизации отсутствует оволосение этих мест. Большинство из них имеют привлекательную женскую фигуру с пышной грудью и округлыми бедрами («идеальная женщина»).
Неполная форма синдрома тестикуляной феминизации может быть с преимущественным развитием по женскому или мужскому типу.
В первом случае ребенок рождается с наружными гениталиями, развитыми по женскому типу (возможна гипертрофия клитера). Но в период полового созревания, помимо отсутствия менструаций, из-за сохранения минимальной чувствительности к тестостерону вторичные половые признаки формируются по мужскому типу (оволосение, мужской тип фигуры, грубый голос) и значительно гипертрофируется клитор. Яички расположены атипично, матка отсутствует.
При преимущественно мужском типе развития (синдром Ренфенштейна) ребенок рождается с мужскими наружными половыми органами (возможна гипоспадия, то есть расположение отверстия уретры на нижней поверхности полового члена ) и развивается до пубертата нормально. Но впоследствии у таких людей регистрируется бесплодие. Яички обычно расположены атипично (в брюшной полости, на уровне паховых колец и т. д.).
Диагностика
Диагностика заболевания основывается на оценке жалоб, анамнеза, данных объективного осмотра и выполнении ряда лабораторных исследований. Отсутствие менструаций у девочек 15-16 лет, имеющих выраженные вторичные половые признаки, является поводом для обращения к гинекологу. Важно установить аномалии строения наружных половых органов у новорожденного. Из семейного анамнеза выявляют наличие подобных случаев у родственников.
Проводится тщательный осмотр для оценки степени развития вторичных половых признаков. Обязательно посещение гинеколога, в ходе которого устанавливается отсутствие матки и яичников.
Необходимо кариотипирование (то есть определение хромосомного набора, в том числе половых хромосом). Обнаруживаемый кариотип — 46 XY. Возможно проведение молекулярно-генетического анализа для выявления мутантного гена.
Для обнаружения мужских гонад и подтверждения отсутствия матки и яичников используют визуализирующие методики — ультразвуковое исследование (УЗИ), магнитно-резонансную томографию (МРТ ).
Лечение
Лечение зависит от степени выраженности проявлений:
- 1. При полной форме проводится обязательное удаление яичек, так как высок риск злокачественных новообразований из-за атипичного расположения и неадекватного температурного режима в брюшной полости (температура на 2-3 градуса выше, чем в мошонке). Для улучшения качества интимной жизни проводят пластику влагалища (его удлинение). Деторождение у фенотипических женщин с синдромом тестикулярной феминизации невозможно, используются вспомогательные репродуктивные технологии (суррогатное материнство).
- 2. При неполной форме с преимущественно мужским развитием проводят пластические операции на наружных половых органах с обязательным низведением яичек в мошонку, резекцию молочных желез при их гиперплазии.
- 3. При неполной форме с женским фенотипом наружным половым органам придают женские формы, яички удаляют. Может потребоваться терапия женскими половыми гормонами.
На момент диагностики важна работа больных с психологами и психотерапевтами с целью формирования адекватного отношения к своему заболеванию.
Беременность при аутоиммунном тиреоидите только усугубляет данное заболевание, при нем собственная иммунная система организма, воспринимая профильные клетки железы как чужеродные, атакует их. Одновременно с выработкой аутоиммунных антител происходит пропитывание органа клетками лимфы — лимфоцитами.
Иммуноглобулины (антитела) и лимфоциты совместно приводят к развитию разрушительных процессов в паренхиме органа. Его масса увеличивается для поддержания эутиреоза — нормального уровня гормонов щитовидной железы в крови. На этом этапе возможно проявление тиреотоксикоза. Вследствие длительной аутоиммунной агрессии при беременности синтетическая функция железы постепенно угасает, развивается гипотиреоз.
Ослабленный болезнью орган не способен синтезировать необходимое для нормального развития плода количество гормонов.
Гормональная недостаточность при беременности и наличие в крови аутоиммунных антител, способных проникать через барьер, образованный плацентой и кровеносными сосудами матери, повышает вероятность недоразвития щитовидной железы ребенка в процессе эмбриогенеза и спонтанных абортов.
Причины
Хронический аутоиммунный тиреоидит развивается на фоне генетического дефекта иммунной системы.
Стимулировать развитие болезни при беременности могут факторы, нарушающие целостность железы и способствующие попаданию ее частиц, обладающих антигенной активностью, в кровоток, что, в свою очередь, запускает процесс выработки аутоиммунных антител. Провоцировать заболевание могут следующие причины:
- тяжелое инфекционное заболевание;
- воспалительный процесс в организме;
- травма щитовидной железы или оперативное вмешательство в орган;
- недостаток или избыток йода;
- недостаток селена в почве в месте проживания пациента;
- радиация.
Во время беременности необходимость в йоде возрастает. Если его поступление в организм не увеличивается пропорционально потребности или уменьшается, то возникает дефицит, способный спровоцировать хронический тиреоидит.
Симптомы
Аутоиммунный тиреоидит у беременных развивается постепенно. В результате того, что под действием антител функциональные клетки разрушаются, в кровь в большом количестве поступают гормоны щитовидной железы. На фоне этого проявляются признаки тиреотоксикоза:
- рвота;
- гипергидроз;
- жар;
- сердцебиение;
- раздражительность.
Все эти признаки часто сопровождают нормально протекающую беременность, поэтому могут не вызвать подозрения.
При пальпации врач эндокринолог может обнаружить диффузное уплотнение железы, появление узлов на ее поверхности.
Пациентка во время беременности может жаловаться на болевые ощущения, затруднения при глотании и дыхании из-за сдавливания трахеи и пищевода увеличенной щитовидкой.
Случается и атрофия — уменьшение щитовидной железы в размере. В любом случае ее функциональная активность при беременности снижена.
На стадии гипотиреоза у женщины могут быть следующие симптомы:
- слабость;
- хроническая усталость;
- сонливость;
- сухость кожи;
- отечность лица и конечностей;
- слишком быстрый набор веса;
- боли при движении;
- расстройства чувствительности;
- зябкость;
- атония кишечника, запоры, тошнота, рвота;
- ломкость ногтей и потеря волос.
Гипотиреозу при беременности сопутствуют нарушения работы сердечно-сосудистой системы:
- замедленное сердцебиение;
- недостаточность кровообращения;
- пониженное давление.
Нередко диагностируют различные виды анемии. Наблюдается нарушение работы почек.
Усугубляет течение болезни при беременности низкая физическая активность, острые инфекции, физические перегрузки, стрессы, прием седативных препаратов, алкоголь.
На плод болезнь может влиять в двух направлениях:
- Аутоиммунные антитела проникают через гематоплацентарный барьер и нарушают эмбриогенез щитовидной железы будущего ребенка.
- Из-за недостаточного количества гормонов и повреждающего действия иммунных комплексов на плаценту уже в первые недели беременности развивается гестоз, плацентарная недостаточность, ведущая к гипоксии плода и выкидышу.
На фоне аутоиммунного тиреоидита могут наблюдаться кровянистые выделения из влагалища, повышение тонуса матки.
В связи с тем что беременность оказывает некоторое иммунодепрессивное действие на организм, аутоиммунный тиреоидит может войти в ремиссию и проявиться уже после родоразрешения.
Диагностика
Диагностика аутоиммунного тиреоидита включает сбор анамнеза с исследованием вероятной наследственности, пальпацию, анализ крови на гормоны щитовидной железы, тиреотропный гормон (ТТГ) и аутоиммунные антитела, УЗИ пораженного органа.
Пальпация позволяет определить форму заболевания (гипертрофическую или атрофическую) в зависимости от изменений размеров органа, наличие у него «деревянистой» плотности и подвижности при глотании.
В крови у больных при беременности обнаруживают повышенное количество антител к тиреоидной пероксидазе и тиреоглобулину — веществам-антигенам и к рецептору гомона ТТГ.
На стадии гипертиреоза в крови обнаруживают повышенное содержание гормонов щитовидной железы — Т3 и свободного Т4 на фоне снижения ТТГ. С уменьшением количества профильных клеток железы количество тиреоидных гормонов сначала держится в пределах нормы, а затем развивается их стойкий дефицит.
С помощью УЗИ определяют размер, плотность и однородность ткани органа. На фоне уплотненной паренхимы обнаруживают узелковые образования. Признаком наличия болезни при беременности является диффузное ухудшение эхогенности органа. В случае неравномерного уплотнения проводят биопсию.
Лечение
Поскольку болезнь неизлечима, терапия тиреоидита во время беременности сводится к профилактике и компенсации гипотиреоза. С этой цель применяют 2 метода.
Первый из них — медикаментозное лечение. Если у пациентки во время беременности диагностируют стабильный гипотиреоз, гормональную терапию проводят синтетическими или полученными из щитовидной железы крупного рогатого скота гормонами.
Применяют следующие препараты: Тиреоидин, Трийодтиронин(Т3), Тироксин(Т4), Тиреотом, Тиреотом-форте.
В большинстве случаев аутоиммунный тиреоидит во время беременности компенсируют назначением левотироксина натрия в несупрессивных дозах, которые корректируют в зависимости от изменений уровня ТТГ в крови. Уровень ТТГ необходимо поддерживать в пределах 0,3 мМЕ/л до 1,5 мМЕ/л. Превышение этого уровня ведет к увеличению дозы препарата на 25 мкг.
Специальное лечение на стадии гипертоксикоза не проводится.
Кроме того, с учетом стадии болезни и срока гестации, проводится симптоматическая терапия. На стадии эутиреоза назначают Йодомарин или другие йодсодержащие препараты для профилактики дефицита микроэлемента у плода. Для предупреждения прерывания беременности на ранних этапах, в 1 триместре назначают седативные, антистрессовые и гормональные лекарственные средства.
Йодомарин и другие подобные препараты на стадии гипотиреоза не применяют из-за их способности стимулировать синтез тиреопероксидазы, что, в свою очередь, провоцирует выработку аутоиммунных антител и усугубление тиреоидита.
Если на более поздних сроках гестации развивается гестоз, помимо седативных и антистрессовых лекарств, назначают гипотензивные, мочегонные, дезинтоксикационные, а также регулирующие реологические и коагуляционые свойства крови аптечные средства.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для лечения щитовидки наши читатели успешно используют Монастырский чай. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Дополнительно применяют препараты, регулирующие плацентарное кровоснабжение, обмен веществ и модулирующие иммунитет, витамины, гепатопротекторы и антиоксиданты.
Если на этапе планирования беременности или уже в послеродовый период врач обнаружил сдавливание увеличенной железой окружающих органов и тканей, может быть назначена операция по частичной резекции гипертрофированного органа.
Последствия
Аутоиммунный тиреоидит часто является причиной невынашивания беременности, плацентарной недостаточности, гипоксии плода, гестоза. Тяжелые дефекты во время эмбриогенеза нередко становятся поводом искусственного прерывания беременности.
Недоразвитие щитовидной железы приводит к тому, что у ребенка после родов диагностируют умственное и физическое отставание в развитии, кретинизм, микседему, врожденные уродства.
В то же время правильное лечение позволяет свести риск осложнений к минимуму.
Нередко аутоиммунный тиреоидит проявляется уже после родов. В этом случае стадия тиреотоксикоза выпадает на период кормления грудью и негативно влияет на качество лактации и здоровье ребенка. Через 7-8 месяцев наступает стадия гипотиреоза.
Профилактика
Если женщина входит в группу риска по аутоиммунному тиреоидиту, необходимы постоянный контроль ее состояния и исключение провоцирующих факторов развития заболевания.
При выявлении аутоиммунных антител в организме на фоне эутиреоза в случае наступления беременности или подтверждения диагноза профилактика сводится к замедлению дистрофических процессов в тканях, раннему обнаружению и компенсации недостатка гормонов щитовидной железы как на ранних сроках гестации, так и после родов.
Можно ли забеременеть при аутоиммунном тиреоидите
Женское бесплодие в 10% случаев связано с аутоиммунным тиреоидитом. Тиреотропные гормоны взаимодействуют с женскими половыми гормонами, обеспечивая созревание яйцеклетки.
При тиреоидите нарушается овуляция и регулярность менструаций, что приводит к невозможности зачатия ребенка.
Если женщина входит в группу риска по тиреоидиту или не может забеременеть дольше 1 года, планирование беременности нужно начать со скрининга уровня иммуноглобулинов к тиреопероксидазе. Количество этого вещества в организме генетически обусловлено и является маркером аутоиммунного тиреоидита.
В случае обнаружения патологии женщине потребуется комплексное лечение, направленное на компенсацию недостатка тиреоидных гормонов в организме.
Источник
