Из за простатита может быть азооспермия
 Выявление азооспермии у пациентов диктует необходимость применения определенного лечебно-диагностического алгоритма. Диагностика заключается в том, что после изучения уровня ФСГ больному производится биопсия яичка и вазография. При этом лечебная тактика зависит от вида азооспермии – секреторной (необструктивной) или экскреторной (обструктивной). Вместе с тем, врачами очень часто игнорируется наличие у больного с впервые выявленной азооспермией сопутствующего хронического простатита (ХП). Возможность осуществления ультразвукового и лабораторного мониторинга в течение длительного времени позволил нам отметить у ряда больных с впервые выявленной азооспермией и ХП появление сперматозоидов в эякуляте в процессе лечения (1). Целью настоящего исследования явилось изучение причин этого явления.
Выявление азооспермии у пациентов диктует необходимость применения определенного лечебно-диагностического алгоритма. Диагностика заключается в том, что после изучения уровня ФСГ больному производится биопсия яичка и вазография. При этом лечебная тактика зависит от вида азооспермии – секреторной (необструктивной) или экскреторной (обструктивной). Вместе с тем, врачами очень часто игнорируется наличие у больного с впервые выявленной азооспермией сопутствующего хронического простатита (ХП). Возможность осуществления ультразвукового и лабораторного мониторинга в течение длительного времени позволил нам отметить у ряда больных с впервые выявленной азооспермией и ХП появление сперматозоидов в эякуляте в процессе лечения (1). Целью настоящего исследования явилось изучение причин этого явления.
В основу исследования положены результаты наблюдения за 1132 больными хроническим простатитом с 1996 по 2011 гг. Обследование и лечение пациентов проводилось в следующих медицинских учреждениях:
1) в городской поликлинике №132 с 1996 по 2008 гг.
2) в Научно-клиническом Центре андрологии и пересадки эндокринных органов г. Москвы с 2002 по 2008 гг.
3) в клинико диагностическом центре и в урологическом отделении НУЗ «Дорожная клиническая больница им. Н.А. Семашко на ст. Люблино» ОАО «РЖД» с 2008 по 2010 гг.
4) в клинико диагностическом отделении поликлиники №3 ЦКБ РАН с 2010 по 2011 гг.
Обследование пациентов с хроническим простатитом включало в себя проведение пальцевого ректального исследования, анализа мочи в трех порциях, секрета простаты, эякулята, бактериологическое исследование секрета простаты и эякулята, проведение ультразвукового сканирования мочеполовых органов, уретроскопию, определение уровня PSA (у пациентов старше 40 лет), исследование гормонального статуса. При обострении хронического простатита проводилась монотерапия антибиотиками в течение 10-15 дней. Комплексное лечение больных с хроническим простатитом начиналось в вне обострения и включало в себя ферментотерапию (внутримышечно лонгидаза 3000 1 раз в 5 дней или подкожно лидаза 64 МЕ или внутримышечно трипсин 0,005 или химотрипсин 0,005 — 1 раз в день); массаж предстательной железы длительностью до минуты с последующей микцией; виброаккустическое воздействие на простатовезикулярный комплекс в течение 15 минут; низкоинтенсивную магнитно-лазерную терапию в инфракрасном оптическом диапазоне и импульсном режиме работы (длина волны 0,89 мкм., мощность излучения 5-15 Вт, суммарная временная экспозиция до 15 мин.). Базовый курс терапии включал в себя 20-25 сеансов, проводившихся ежедневно (кроме субботы и воскресенья). Эякулят исследовался после каждых пяти сеансов лечения т.е. еженедельно.
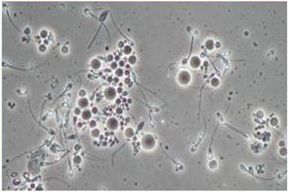
Исследование эякулята у 1132 больных ХП позволило у 419 выявить патологические изменения, из них в 136 случаях выявить азооспермию. Так как патоспермия практически во всех случаях сочеталась с инфекционным простатитом, первым этапом было проведено комплексное лечение простатита, а вторым дообследование и лечение генеративных нарушений. После 10 сеансов терапии у 18 больных с азооспермией в эякуляте появились сперматозоиды. Повторный анализ через неделю подтвердил ранее полученные результаты: у 7 пациентов показал нормальную концентрацию, подвижность и морфологию сперматозоидов. У 11 пациентах отмечались различной выраженности олиго-, астено- и тератозооспермия при концентрации сперматозоидов более 10 млн./мл. Определение уровней половых гормонов в периферической венозной крови крови не выявило ассоциированное со снижением секреции ингибина увеличение концентрации ФСГ. Это обстоятельство позволило нам предположить то, что причиной азооспермии является экскреторный фактор т.е. временная (транзиторная) обструкция. Ультразвуковой мониторинг этих больных в процессе лечения позволил отметить исчезновение зон эхографической неоднородности вблизи прохождения семявыбрасывающих протоков на фоне уменьшения объема предстательной железы по сравнению с началом лечения.
У пациентов с ХП может встречается феномен преходящей (транзиторной) азооспермии. По всей вероятности, воспалительный отек интерстициальной ткани центральной зоны простаты за счет компрессии семявыбрасывающих протоков может нарушать их проходимость. Поэтому сперматозоиды не имеют возможность продвигаться в уретру во время эякуляции. При уменьшении воспалительного отека в процессе лечения проходимость обоих семявыбрасывающих протоков восстанавливается за счет исчезновения компрессии извне. Это приводит к тому, что после 10 сеанса лечения в эякуляте появляются сперматозоиды. Таким образом, в случае выявления азооспермии у больных с ХП целесообразно в первую очередь проводить лечение простатопатии. При этом крайне важно иметь возможность мониторировать лечебный процесс.
Источник: ТРАНЗИТОРНАЯ АЗООСПЕРМИЯ ПРИ ЛЕЧЕНИИ БОЛЬНЫХ С ХРОНИЧЕСКИМ ПРОСТАТИТОМ Капто А.А., Виноградов И.В. Кафедра клинической андрологии ФПКМР РУДН г. Москва 2012
Автор: admin
- Ссылка Автора:
- Все статьи
Источник
Азооспермия — отсутствие сперматозоидов в эякуляте (семенной жидкости). Является одной из причин бесплодного брака. Распространенность азооспермии среди всех мужчин составляет менее 1%, среди мужчин, состоящих в браке и не имеющих детей — 11-14 % [1][2]. Азооспермию следует рассматривать, скорее, как патологический симптомокомплекс, а не в качестве самостоятельного заболевания.
Причины возникновения азооспермии подразделяют на тестикулярные, претестикулярные и посттестикулярные.
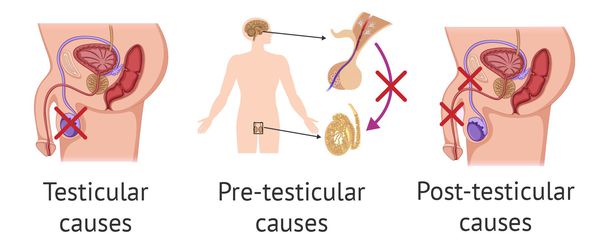
Тестикулярные причины обусловлены:
- генетическими факторами (отсутствием лоскута Y-хромосомы, отвечающего за сперматогенез; синдромом Клайнфельтера — наличие дополнительной женской половой X-хромосомы; муковисцидозом, приводящим к врождённому отсутствию семявыводящих протоков [8]; синдромом Юнга, характеризующимся систематической закупоркой протоков яичка; синдромом Прадера-Вилли — отсутствием отцовской копии участка хромосомы [9]);
- врождёнными аномалиями (недоразвитием (аплазией) яичек; крипторхизмом — несвоевременным выходом яичек из брюшной полости наружу; варикоцеле);
- осложнениями инфекций (орхитом после перенесённого паротита и другими);
- половыми излишествами (недозреванием половых клеток в придатках яичка);
- сахарным диабетом (нарушением обмена веществ в яичке).
К претестикулярным причинам следует отнести:
- опухоль гипофиза, кровоизлияния в головной мозг;
- дисфункцию гипоталамуса (неправильную выработку гормонов);
- гипогонадотропный гипогонадизм (недостаточность сперматогенеза вследствие отсутствия стимуляции его гонадотропинами);
- токсические воздействия (наркотики, алкоголь, препараты тестостерона, антибиотики, стероиды, противовоспалительные препараты и пестициды);
- воздействие ионизирующей радиации (а также рентгеновского излучения) и лучевой терапии;
- постоянную гипертермию (частое посещение бани или сауны, заболевания, сопровождающиеся высокой температурой);
- тяжёлые физические и психологические нагрузки, стрессы;
- недостаток витаминов и микроэлементов в пище.
Протестикулярные причины заключаются в обструкции (препятствии) и нарушении семенных протоков. Этому способствует:
- проведение вазэктомии, перевязывания семявыводящих протоков и вазографии семенных путей с применением контрастных средств;
- осуществление оперативного вмешательства в область эякуляторных каналов;
- наличие воспалительных заболеваний, опухолей придатков яичка, семенных пузырьков и предстательной железы;
- использование метода грыжесечения (в особенности у детей) с целью пластики грыж полипропиленовых сеток, который вызывает в окружающих тканях фиброз и вовлекает семявыводящие протоки с дальнейшей их полной облитерацией (заращением);
- возникновение ретроградной эякуляции (полный или частичный выброс семенной жидкости в мочевой пузырь) и нарушение эмиссии (сперма не поступает в заднюю часть мочеиспускательного канала);
- онкологические заболевания крови (лейкоз, болезнь Ходжкина) [11].
Основной симптом — невозможность зачать ребёнка (крайне малое количество сперматозоидов в эякуляте или же их полное отсутствие) при сохранённой сексуальной функции.
Косвенные симптомы:
- обнаружение гена наследственной патологии или её признаков;
- повышение числа антиспермальных тел в эякуляте;
- малое количество семенной жидкости, возникающее во время эякуляции;
- белые непроизвольные выделения из мочеиспускательного канала;
- повышенное оволосение;
- малый размер яичек при их повышенной плотности;
- гипоплазия (уменьшение) предстательной железы;
- сексуальные дисфункции после инфекционного заболевания.
Чтобы лучше понять патологические процессы, происходящие со сперматозоидами, рассмотрим нормальную физиологию сперматогенеза.
Сперматозоиды и мужские половые гормоны (андрогены) вырабатываются в основных половых железах мужчины — яичках. Этот процесс называется сперматогенезом. Одни из самых важных клеток яичка — клетки Лейдега (описаны в 1850 году Францем Лейдегом). Они вырабатывают тестостерон — основной мужской половой гормон, а также клетки иммунной системы — макрофаги и лимфоциты. В канальцах яичка осуществляется сперматогенез с активным участием клеток Сертоли. Эти клетки синтезируют множество факторов, участвующих в образовании сперматозоидов: белки, гормоны, биологически активные вещества, именно они определяют объём яичек, качество и количество спермы.
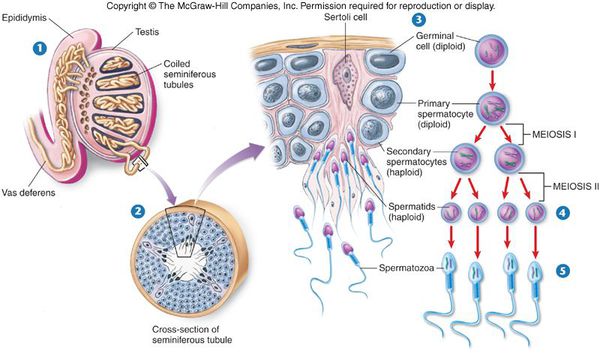
Образование сперматозоидов начинается в канальцах яичка с делением стволовых клеток и заканчивается путём сложных преобразований в зрелые сперматозоиды. Дозревание и концентрация сперматозоидов происходит в небольшом придатке яичка (а именно в его хвосте), где спермии могут сохранять жизнеспособность в течение двух недель. Попадают недозрелые сперматозоиды из более извитых канальцев яичка за счёт смывания их жидким секретом клеток Сертоли в более прямые канальцы, сливающиеся в общий канал придатка яичка. Далее сперма эвакуируется из мужского организма путём эякуляции, при помощи эрекции. В ответ на сексуальные стимулы эректильные парасимпатические нервы выделяют ацетилхолин, который расширяет артерии промежности, увеличивает кровоток в кавернозных и губчатых телах полового члена. Это способствует набуханию пениса — эрекции.
Далее происходит эмиссия — прохождение спермы в мочеиспускательный канал. Подчревные симпатические нервы выделяют адреналин, который вызывает сокращение гладких мышц, окружающих выносящие канальцы и хвост придатка яичка. В момент эякуляции нервы нижнего поясничного и верхнего крестцового центров вызывает сокращение бульбокавернозных мышц, что приводит к резкому выбросу спермы из уретры. Одновременно с этим, импульсы восходящих нервов создают ощущение оргазма.
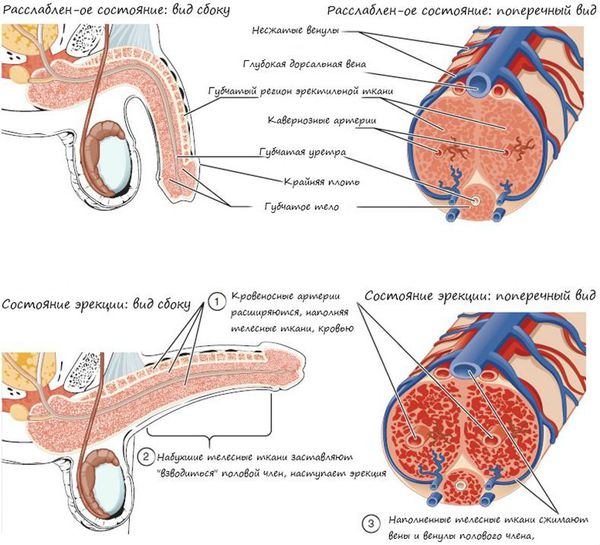
Наконец, детумесценция (прекращение или спад эрекции после эякуляции и оргазма) связана с выделением норадреналина симпатическими нервами, также вырабатывается пролактин. Это приводит к сужению сосудов органа и его последующей вялости.[3]
Патогенез азооспермии разнообразен и зависит от конкретных причин.
При обструктивной азооспермии сперматозоиды вырабатываются в нормальном количестве, но при этом нарушается проходимость протоков. В связи с этим сперматозоиды не могут выйти наружу и оплодотворить яйцеклетку. При непроходимости протока придатка яичка наблюдается нормальный размер яичек и уровень фолликулостимулирующего гормона (ФСГ), а также уплотнение и отёк придатка.[4]
При наследственных аномалиях обращает на себя внимание целостность Y-хромосомы. Этот фактор является необходимым условием нормального строения и функционирования мужской половой системы. Особую роль в сперматогенезе играют три участка длинного плеча этой Y-хромосомы: AZFa, AZFb, AZFc.[5] Иначе они называются “факторами азооспермии”. Потеря одного из них приводит к тяжёлым нарушениям плодовитости (фертильности). Подобное нарушение может возникнуть по причине мутаций зародышевых клеток отцовской линии. При азооспермии эта патология встречается в 5-10% случаев, при олигоспермии — с частотой до 5%.[6] Клинически проявляется в резком нарушении сперматогенеза. При этом эндокринная функция яичек остаётся в норме, а их клеточное строение варьируется от наличия в канальцах зародышевых клеток с нарушением сперматогенеза (очаговый Сертоли), до блокады или ослабления процесса формирования и созревания сперматозоидов. Уровень ФСГ остаётся в норме или немного повышен.
Интересен механизм нарушений при муковисцидозе (кистозном фиброзе). Эта генетическая патология является наиболее распространённым и неизлечимым на данный момент заболеванием белой расы, поражающее одного из 2500 младенцев. Люди с данной болезнью чаще всего умирали, не достигая зрелого возраста, поэтому их фертильность не принималась во внимание. Однако совершенствование диагностики и методов лечения повлияло на увеличение количества больных, способных дожить до 30 лет и более, в связи с чем муковисцидоз приобрёл важное клиническое значение.
Причина муковисцидоза — мутирующий ген CFTR (трансмембранный регулятор муковисцидоза). Нарушение структуры данного белка способствует образованию вязкости секрета бронхов и закупорке (обструкции) дыхательных путей, развитию правожелудочковой недостаточности, нарушению работы поджелудочной железы, непроходиомости кишечника у новорождённых с застоем первородного кала (мекония). Основной признак данного заболевания — повышенная содержание хлорида в поте. Для взятия анализа потоотделение стимулируют местным электрофорезом препарата «пилокарпин».[7]
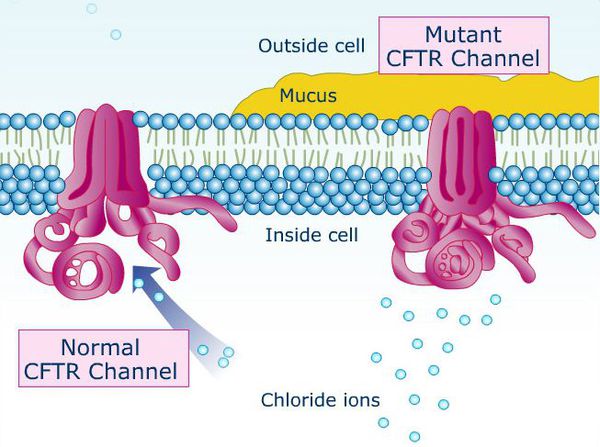
В типичных случаях при муковисцидозе внутримошоночная часть семявыводящего канала либо полностью отсутствует, либо изменена до лентовидной структуры, которая лишена просвета. Тело и хвост придатков яичка недоразвиты, его ткань, в основном, не изменена, но могут быть участки отложения солей кальция в мягких тканях (кальциноз), кистозные и гипоэхогенные (недостаточно плотные) участки (можно обнаружить при УЗИ). Врождённому отсутствию (аплазии) семявыводящего канала и придатка яичка сопутствуют патологические изменения семенных пузырьков: их отсутствие, гипоплазия (недоразвитие), обтурация (закупоривание) и кистозное изменение. В связи с этим уменьшается объём эякулята. Интересно, что фертильность сохраняется у большинства мужчин, а при нарушениях сперматогенеза можно достаточно быстро восстановить фертильность.[8]
Заслуживает внимания в патогенезе азооспермии синдром Прадера-Лабхарта-Вилли. В основе этого синдрома лежит потеря целого кластера на участке 15q11-q13 проксимальной области длинного плеча хромосомы 15. Дети с этим синдромом развиваются медленно. Если в младенчестве они выглядят худыми, то к моменту начала ходьбы они становятся очень толстыми. В зрелом возрасте развивается значительное ожирение при маленьком росте (менее 155 см). Руки и ноги у таких детей маленькие, даже по отношению к небольшому росту, имеется гипопигментация, нарушение умственного развития. У пациентов с синдромом Прадера-Вилли гениталии не развиты, характерен микропенис, двухстороннее неопущение яичек и недоразвитие мошонки. Уровень основных половых гормонов (тестостерона, ФСГ, ЛГ) резко снижен.[9]
Азооспермия бывает обструктивной, необструктивной (секреторной) и транзиторной (временной).
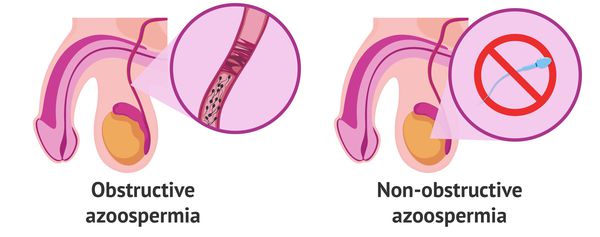
Обструктивная форма азооспермии связан с закупоркой (обструкцией) семявыводящих путей вследствие разных причин.
Необструктивная форма возникает по причине нарушения выработки (секреции) сперматозоидов.
При транзиторной форме заболевания сперматозоиды в эякуляте отсутствуют определённый промежуток времени, однако между подобными эпизодами возможно оплодотворение женщины естественным путём. Транзиторная азооспермия может возникнуть как в связи с обструктивными, так и секреторными причинами. Также временная азооспермия подразумевает, что при исключении токсических или вредных факторов воздействия фертильность мужчины восстанавливается естественным образом.[10]
- нарушение репродуктивной функции (бесплодие);
- снижение половой активности;
- семейные проблемы (вплоть до расторжения брака), как следствие вышеизложенных причин;
- психические и неврологические нарушения (бессонница, неустойчивое настроение, неврозы, депрессия, суицидальные попытки).
- Развёрнутая спермограмма. В соответствии с рекомендациями Всемирной организации здравоохранения, данный метод диагностики считается достоверным при отсутствии сперматозоидов как минимум в двух пробах, между которыми должно пройти 2-3 недели. Для установления временной азооспермии требуется ещё одна повторная спермограмма с интервалом в 2-3 месяца (столько необходимо времени для образования, созревания и перемещения половых клеток).
- Генетическое исследование крови. Предполагается установление кариотипа, гена белка СFTR, а также анализ на микроделеции (отсутствие) участка AZF Y-хромосомы.
- УЗИ мошонки с описанием размеров, структуры яичек и их придатков.
- ТРУЗИ предстательной железы и семенных пузырьков.
- МСКТ, МРТ тестикул и простаты.
- Исследование в эякуляте маркtрных веществ (цинка, фруктозы, альфа-глюкозидазы).
- Исследование гормонального статуса: тестостерон свободный и связанный, ФСГ, ЛГ, пролактин, ингибин В, ГСПГ — глобулин, связывающий половые гормоны.
- МРТ гипофиза.
- Двухсторонняя биопсия яичка (для оценки сперматогенеза). Более точной результат устанавливается путём проведения открытой диагностической биопсии яичка (TESE). Данный метод диагностике необходимо проводить совместно с забором сперматозоидов через прокол с последующей их криоконсервацией. Это позволит использовать сперматозоиды в дальнейшем при ЭКО и ИКСИ (искусственном оплодотворении).
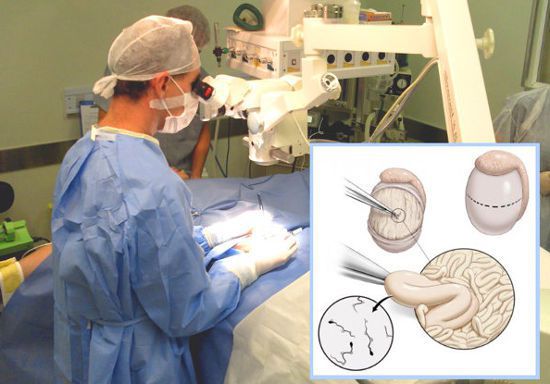
Если у пациентов с азооспермией или тяжелой олигозооспермией нормальный размер яичек и уровень гормонов, то это может свидетельствовать о наличии обструкции семенного канала.[12]
Лечение направлено на устранение фактора, приведшего к нарушению репродуктивности (плодовитости) мужчины.
Лечение обструктивной азооспермии
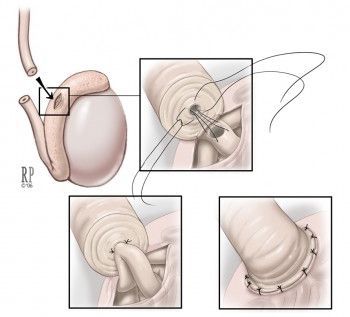
Один из ведущих методов лечения — реконструктивная операция. С её помощью можно восстановить проходимость семявыносящих путей. Для этого применяется пластика уретры, наложение вазо-вазоанастомоза (соустья) или вазо-эпидидимоанастомоза.
Если обструкция семенных путей возникла на уровне придатка яичка, то в таком случае рекомендуется проведение микрохирургической эпидидимовазостомии по типу «конец в конец» или «конец в бок»: соединение семявыносящего протока с протоком придатка яичка происходит ближе (проксимальнее) к уровню обструкции. При этом предпочтительна такая техника операции, как микрохирургическая инвагинация (впячивание) эпидидимовазостомы.[13]

Реконструкция бывает односторонней и двусторонней, причём восстановление проходимости и частота беременностей обычно выше при двусторонней операции. Переход к микрохирургическому этапу вмешательства следует осуществлять в случае подтверждения проходимости семенных канальцев ниже придатка яичка. Анатомическое восстановление проходимости (реканализация) после реконструкции может продлиться от 3 до 18 месяцев.
До микрохирургического вмешательства (а также в случаях невозможности реканализации) необходимо провести извлечение сперматозоидов из придатка яичка (аспирацию) с последующей их криоконсервацией, которая может потребоваться для ИКСИ при неэффективности хирургической реканализации.[14]
Таким образом, реконструкция происходит поэтапно: ревизия мошонки и извлечение сперматозоидов из придатка яичка с последующей криоконсервацией семени, и затем проводится микрохирургическое восстановление семенных путей.[15] Восстановление фертильности после такого метода лечения происходит более чем в 50% случаев.
Лечение секреторной азооспермии
При данной форме азооспермии используется заместительная или стимулирующая гормональная терапия, корректирующая эндокринные расстройства. Этот метод лечения способен привести к восстановлению сперматозоидов в эякуляте. Также гормональная лекарственная терапия может быть очень эффективным способом восстановления фертильности при нарушениях гипоталамо-гипофизарной системы (гипогонадотропном гипогонадизм). В случаях хронических инфекционных процессов проводится антибактериальное и противовоспалительное лечение с учётом возбудителя.
Лечение транзиторной азооспермии
При лечении этой формы заболевания уделяют внимание устранению вредного фактора, а также проводят оперативное или гормональное лечение в зависимости от предпочтительной причины, которая может быть как секреторной, так и обструктивной. Данный случай отличается тем, что тяжёлые нарушения сперматогенеза ещё не наступили, поэтому процесс нарушения фертильности вполне поддаётся быстрому регрессу.
Если же при проведённом хирургическом и консервативном лечении фертильность восстановить не удалось, то следует обратиться к вспомогательным репродуктивным технологиям. ИКСИ является самым эффективным методом искусственного оплодотворения. Для данной процедуры необходимо получить сперматозоиды путём открытой/аспирационной биопсии яичка (TESA/TESE) или придатка яичка (MESA, PESA).[16]
При неустранимых причинах азооспермии (в основном, при генетических нарушениях) успешное лечение мужского бесплодия является трудно выполнимой задачей. В таком случае для оплодотворения супругам стоит воспользоваться донорской спермой. При обструктивной азооспермии шанс зачать ребёнка естественным путём или с использованием метода репродуктивной технологии выше, чем при секреторной форме заболевания. В подавляющем большинстве случаев причинами возникновения азооспермии являются необратимые нарушения работы яичек, приводящие к глубокому нарушению сперматогенеза.[17]
Профилактика:
- своевременное лечение инфекционных заболеваний, в том числе урогенитальных;
- раннее генетическое обследование при подозрении на наследственные нарушения, приводящие к бесплодию;
- исключение травм и ушибов яичек;
- сбалансированный рацион питания, обеспечение правильного физического развития в период полового созревания.
Источник
