Иммуностимуляторы при хроническом простатите
Симченко Н.И.
Могилевская областная больница
Введение.
Хронический простатит является самым распространенным урологическим заболеванием у мужчин моложе 50 лет и третьим по частоте урологическим диагнозом у мужчин старше 50 лет (после доброкачественной гиперплазии и рака простаты), составляя 8% амбулаторных визитов к урологу[1]. С возрастом частота заболевания увеличивается и достигает 30-73% . Влияние этого заболевания на качество жизни сопоставимо с инфарктом миокарда, стенокардией, болезнью Крона, что обуславливает также и значительные психологические и социальные проблемы у больных простатитом мужчин трудоспособного возраста.[3] При определении относительной частоты выявления разных форм хронического простатита большинством специалистов было показано, что на долю хронического бактериального простатита (ХБП) приходится 5-15 % случаев заболевания, в то время как на долю воспалительного синдрома хронической тазовой боли приходится 60-65% случаев, а около 30 % составляют больные с невоспалительным синдромом хронической тазовой боли.[2] С позиции патологической анатомии, простатит определяется повышением количества воспалительных клеток в паренхиме предстательной железы. Частым признаком воспаления является лимфоцитарная инфильтрация в строме предстательной железы[5] . Для пациентов с хроническим бактериальным простатитом характерны патологические изменения иммунологических показателей, свидетельствующие о депрессии иммунной системы (снижение уровней ИФНα и ИФНγ, sIgA, функциональной активности нейтрофилов, повышение концентраций IgA, IgG, IgM).[4]
Инфекция простаты может быть следствием бактериальной колонизации мочеиспускательного канала.[7] Бактериальная колонизация может также вызвать персистенцию бактерий в простате. Отличительной чертой этого состояния является персистенция бактерий внутри простаты, несмотря на лечение антибиотиками, что связано с хроническим воспалением простаты и склонностью к обострению инфекции мочевыводящего тракта тем же самым патогеном.[8] Диссинергия при мочеиспускании может привести к анатомически чрезмерной стимуляции нервных волокон, иннервирующей область промежности и таза, с последующим развитием хронического невропатического болевого состояния. Или, такое высокое давление и дисфункциональное мочеиспускание могут вызвать интрапростатический рефлюкс мочи в протоки у части больных. [11]
Рефлюкс мочи и, возможно, бактерий в протоки простаты является одним из самых важных механизмов патогенеза хронического бактериального и абактериального воспаления при простатите. По своей анатомии система дренажа протоков периферической зоны более чувствительна к интрапростатическому рефлюксу в протоки, чем другие области простаты[9]. Если патогенные бактерии попадают в предстательную железу с помощью рефлюкса, они могут существовать в виде защищенных агрегатов внутри камней простаты. Большое количество культур патогенов, покрывающих камни в простате, было показано Eykyn (1974). Этот способ колонизации бактерий, который заключается в образовании защищающих бактериальных агрегатов или биопленок, связанных с камнями простаты, может приводить к развитию неподдающегося лечению ХБП и к последующей рецидивирующей инфекции мочевых путей.
При абактериальном простатите бактериальное воспаление простаты может быть вторичным иммунологически опосредованным воспалением, вызванным каким-нибудь неизвестным антигеном, или, возможно, воспаление может быть связанно с аутоиммунным процессом. Уровни антител IgA(сывороточный IgA является фракцией гамма-глобулинов и составляет 10-15 % от общего количества всех растворимых иммуноглобулинов. IgA обнаруживаются преимущественно в секретах) и IgM (неспецифичных к микроорганизмам) повышаются[6], подобные антитела, так же как фибриноген и С3 компонент комплемента[12] были обнаружены при биопсии простаты у больных с хроническим простатитом. Каким бы ни было начальное событие, оказывается, что иммунологический каскад играет важную роль при развитии простатита[15].
При хроническом бактериальном простатите характерны патологические изменения иммунологических показателей, свидетельствующие о депрессии иммунной системы (снижение уровней ИФНα и ИФНγ, sIgA, функциональной активности нейтрофилов, повышение концентраций IgA, IgG, IgM).[14] В исследованиях с использованием иммунофлюоресцентных методов диагностики было установлено отложение в тканях предстательной железы больных хроническим уретрогенным простатитом IgA и IgM, фибриногена, С. компонента комплемента [13]. Кроме того, в тканях предстательной железы как при хроническом бактериальном, так и при абактериальном простатите была выявлена экспрессия HLA DR, большого количества Т-лимфоцитов с преобладанием субпопуляций CD8+ над CD4+, повышенного количества антигенпрезентирующих клеток и тканевых макрофагов, отсутствие В-лимфоцитов [10]. Эти данные свидетельствуют о том, что воспалительная реакция при хроническом простатите носит характер иммунной клеточной реакции,
Материалы и методы
Были сформированы 2 группы пациентов – 1- с иммунокоррекцией на фоне стандартного комплекса лечения и 2 – без иммунокоррекции.
Продолжительность исследования составила 4 месяца, в течение которых было проведено 3 визита. На скрининговом визите (0) оценивалось соответствие пациента критериям включения/исключения. Далее проводился опрос и клинический осмотр. Симптомы хронического простатита оценивались по шкале Национального института здоровья США NIH-CPSI.
Были проведены клинические анализы крови и мочи, бактериологическое и микроскопическое исследование секрета предстательной железы, а также трансректальное ультразвуковое исследование. В течение 1 визита уточнялось соответствие пациента критериям включения/исключения c учетом данных лабораторных исследований. Образец венозной крови использовали для иммунологического анализа, уровня иммуноглобулинов IgA, G и М
Результаты и их обсуждение
В исследование были включены 40 пациентов в возрасте от 20 до 54 лет (средний возраст 38,8±9,1 лет). Подавляющему большинству исследуемых (17 человек – 42,5%) было на момент начала исследования от 40 до 49 лет.
Выраженность симптомов хронического простатита оценивалась по шкале NIH-CPSI. На скрининговом визите суммарный балл в среднем составил 26 баллов.
В ходе лечения уровень выраженности симптомов хронического бактериального простатита снизился в обеих группах. При этом в первой группе суммарный балл по шкале NIH-CPSI на 2 и 3 визите был статистически значимо ниже, чем в контрольной (p<0,05).
Бактериологическое исследование секрета простаты, выполненное после окончания терапии, выявило эрадикацию патогенных микроорганизмов у 60-70% пациентов с простатитом в обеих группах. При этом в экспериментальной группе(c иммунокоррекцией) наблюдалась более полная элиминация инфекционного агента.
После лечения в секрете предстательной железы у 50% пациентов экспериментальной группы отмечено снижение количества лейкоцитов до не более 10 в поле зрения, при этом в контрольной группе этот результат был достигнут только у 15%. Это говорит о том, что в экспериментальной группе снижение интенсивности воспалительного процесса было более выражено.
Уровень sIgA в секрете предстательной железы определяли до и после лечения (n=6).
До лечения концентрация IgA была значительно ниже нормы. В обеих группах после лечения уровень секреторного IgA повысился, причем в первой группе практически в 2 раза, во второй – только в 1,5 раза. Это свидетельствует об усилении местных защитных реакций, которое было более выражено в экспериментальной группе
Иммунологические параметры
Исследовался уровень Т- и В-лимфоцитов в % и абсолютных цифрах, уровень Т-х и Т-с, нулевые лимфоциты, ИН(индекс нагрузки) и иммуноглобулины А, М,G.
Статистически значимых изменений в процентном содержании Т- и В-лимфоцитов не выявлено, однако при изучении абсолютных показателей до лечения выявлено снижение В-л у 47% пациентов, Т-л – у 23 %, сочетание – у 23,5%.
ИН был повышен у 64,7%, хотя Т-х были выше нормы только у 5 % пациентов, а Т-с ниже нормы тоже только у 5%. Т.е. у большинства больных хроническим простатитом отмечается выраженный дисбаланс в клеточном звене иммунитета.
Гуморальный иммунитет
До начала лечения уровень IG A был повышен у 11% пациентов, что свидетельствует о аутоиммуном компоненте заболевания. Снижение содержания IgA свидетельствует о недостаточности гуморального и местного иммунитета. Увеличение концентрации может свидетельствовать об острых и хронических инфекционных процессах . Низкий уровень содержания Ig M отмечен у 12,7% пациентов, из них у 2 (5%) полное отсутствие Ig M. (IgM – первый иммуноглобулин, отвечающий на внедрение инфекции. Является маркером остроты процесса. Снижение показателя говорит об иммунодефиците)
IgG –основной иммуноглобулин в сыворотке, служит для долговременной защиты от инфекций. Аутоантитела относятся к этому классу. У 12,8% пациентов отмечено повышение уровня IG G, что свидетельствует об аутоиммуном компоненте воспаления.
Выводы
- Лечение хронического воспалительного процесса в предстательной железе невозможно без иммунокоррекции, но адекватная иммунокоррекция должна проводится только под иммунологическим контролем.
- Для коррекции дисбаланса в клеточном звене рекомендуется использование ликопида 1 мг 1 разсутки в течение 10 дней , с последующим контролем иммунограммы (повышает уровень В-л и Т-с)
- Для снятия аутоиммной активности рекомендуется использование метронидазола 100,0 вв 1 раз в сутки 7-10 дней и десенсибилизирующей терапии (лоратадин)
- Для коррекции Т-В лимфоцитов –декарис 150 мг 1 раз в сутки 3 дня подряд или 1 раз в неделю 3 недели подряд с контролем иммунограммы через 2 недели после курса.
- При отсутствии IgM мы применяли свечи лаферобион 500 000 ед по 1 свече 2 раза в сутки в течение 10 дней и свечи витапрост-форте по 1 в сутки в течение 20 дней. Восстановление иммуноглобулина происходило в течение 1 месяца и сохранялось на нормальных значениях при контроле через 6 месяцев
- Не рекомендуется длительная (более 7 дней) иммуностимуляция (особенно без контроля иммунограммы). Избыточная иммуностимуляция провоцирует аутоиммный компонент воспаления и воспаление, вызываемое ею может быть причиной роста интрапростатического давления
Литература.
1. Мазо Е.Б., Степенский А.Б., Гамидов С.И., Григорьев М.Э., Кривобородов Г.Г., Белковская М.Н. Фармакотерапия хронических простатитов. РМЖ 2001; т.9 , № 23.
2. Степенский А.Б., Попов С.В., Муфагед М.Л. Диагностика и лечение хронического простатита. Consilium medicum 2003, т.5, № 7: 396-401.
3. Набер К., Бергман Б. и др. Рекомендации Европейской ассоциации урологов по лечению инфекций мочевыводящих путей и инфекций репродуктивной системы у мужчин. Клиническая микробиология и антимикробная химиотерапия 2002; т.4,№ 4: 347-363.
4. McNaughton-Collins M, Stafford RS et al: How common is proitis? A national survey of physician visits. J Urol 1998; 159: 1224-1228.
5. Luzzi G. The proitis syndromes.Int STD and AIDS 1996; 7:471-478
6. Krieger JN, Egan KJ: Comprehensive evaluation and treatment of 75 men referred to chronic proitis clinic. Urology 1991; 38: 11-19.
7. Kohnen PW, Drach GW: Patterns of inflammation in proic hyperplasia: A histologic and bacteriologic study. J Urol 1979;121:755-760.
8. Weidner W, Schiefer HG, Krauss H, et al: Chronic proitis: A thorough for etiologically involved microorganisms in 1461 patients. Infection 1991b; 19:119-125.
9. Bergman B: On the relevance of gram-positive bacteria in proitis. Infection 1994; 22(Supp l):22.
10. Domingue GJ: Cryptic bacterial infection in chronic proitis: Diagnostic and therapeutic implications. Curr Opin Urol 1998;8:45-49.
11. Krieger JN, Riley DE, Roberts MC, Berger RE: Prokaryotic DNA sequences in patients with chronic idiopathic proitis. J Clin Microbiol 1996b;34:3120-3128.
12. Zermann DH, Schmidt RA: Neurophysiology of the pelvic : Its role in proe and pelvic pain. Textbook of Proitis. Oxford, UK, ISIS Medical , 1999, pp 95-105.
13. Workshop Committee of the National Institute of Diabetes and Digestive and Kidney Disease (NIDDK) Chronic Prois Workshop. Bethesda. Md., 1995.
14. Meares E. M, Stamey T. A. Invest. Urol 1968; 5; 492.
15. Bjerclund Johansen T.E., Gruneberg R. N., Guibert J. et. al. The Role of Antibiotics in the Treatment of Chronic Proitis: A Consensus ement. Eur. Urol 1998; 34: 457-466.
Источник
27 октября 2020
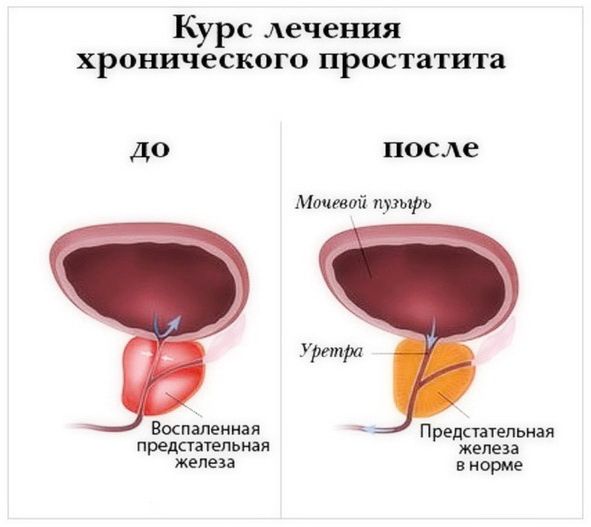
Простатит неодинаково протекает у разных мужчин. Какие-то симптомы бывают более выраженными, какие-то отсутствуют. Большое значение имеет стадия болезни, наличие гиперплазии предстательной железы или аденомы. Врачи учитывают, впервые развилось воспаление или уже имеется стаж.
Подобрать лечение простатита у мужчин, найти самые эффективные средства для каждой стадии простатита может только врач-уролог, после обследования и получения результатов анализов.
Тем не менее ориентироваться в средствах для лечения простатита должен каждый, кто столкнулся с этой проблемой.

Виды лекарств от простатита у мужчин
Урологи применяют несколько групп препаратов.
- Антибиотики — самыми лучшими при этой болезни остаются фторхинолоны (Офлоксацин, Таваник) и макролиды (Вильпрафен).
- Противовоспалительные — Индометацин, Диклофенак, Кетотифен.
- Блокаторы адренорецепторов типа альфа-1 — Омник.
- Лекарства на основе экстракта простаты — Простатилен, Витапрост, Простакор, Сампрост, Уропрост.
- Растительные препараты — Простамол Уно, Простагут форте, Простанорм.
Антибиотики борются с инфекцией в мочевом тракте, все прочие средства снижают воспаление, уменьшают отёк и боль, облегчают отхождение мочи, улучшают кровоснабжение половых и мочевыводящих органов.
Существует масса гомеопатических средств от простатита и потенции, производные интерферона, которые в статье не рассматриваются. Их польза не доказана в исследованиях.
Каким должно быть лучшее средство от простатита у мужчин
Лечение, назначенное врачом, должно достигать следующих целей:
- уничтожение вредных бактерий;
- снятие воспаления;
- ликвидация застойных явлений в простате;
- улучшение иммунитета;
- восстановление нормального мочеиспускания;
- улучшение потенции и предотвращение эректильной дисфункции.
Единственного препарата, который в полной мере отвечает всему перечисленному, нет. Поэтому урологи прописывают приём 2–3 препаратов, подобранных индивидуально в каждом случае. Лекарства сочетают с массажем, физкультурой, физиопроцедурами.
Для лечения простатита у мужчин самыми эффективными средствами считаются ректальные свечи, поскольку поставляют лекарство к железе, минуя печень и создают в тканях высокую лечебную концентрацию.
Топ-5 эффективных средств для лечения простатита
Эти препараты обладают комплексным действием, проверены в клинической практике.
Витапрост
Свечи и ампульный препарат экстракта простаты. Эффективен при остром и хроническом воспалении, поскольку в состав лекарства входит антибиотик.
Лонгидаза
Бактерицидным действием не обладает, назначается вместе с антибиотиком. Подходит в хронических случаях, когда уже появился воспалительный фиброз в органе, спайки, разрастание ткани простаты. Результативна при болезни Пейрони.
Простатилен
Инъекции и ректальные свечи. В сочетании с антибактериальным средством снимает воспаление, нормализует мочеиспускание, улучшает эрекцию.
Простамол Уно
Растительный препарат. Выпускается в капсулах. Уменьшает боли, восстанавливает ток мочевой струи, нормализует потенцию.
Простанорм
Лекарство из растительного сырья. Применяется больше для профилактики, продления ремиссии при хроническом процессе. Имеет небольшой антибактериальный эффект, убирает боль, стимулирует иммунитет, улучшает кровоснабжение железы и отток мочи.
При снижении тонуса мочевыводящей системы врачом по рецепту назначается Омник. В осложнённых случаях при аденоме простаты может потребоваться применение финастерида для регуляции баланса тестостерона.
Хорошо себя зарекомендовали как лекарства от простатита недорогие Ихтиоловые свечи, ампульный Простакор.
Недопустимо самостоятельное применение медикаментов без учёта бактериальной флоры и стадии болезни. Терапия острого простатита под присмотром врача убережёт от осложнений и перехода в хроническую форму.
Для назначения лечения обращайтесь к урологу клиники Dr. AkNer по телефону или через форму обратной связи. Звоните, опытный специалист выберет вам препараты и проконтролирует лечение до выздоровления.
Врач уролог, андролог Акопян Нерсес Григорьевич.
Источник
Статьи
Опубликовано в журнале:
«УРОЛОГИЯ» »» 2010 №5
М. И. Шотохин1, О. В. Теодорович1, А. И. Конопля2, В. П. Гаврилюк2, М. Ю. Маврин1, А. В. Краснов1
1ГОУ ДПО Российская медицинская академия последипломного образования (ректор – акад. РАМН Л. К. Мошетова) Минздравсоцразвития России, урологический центр НУЗ Центральная клиническая больница № 1 (дир. – канд. мед. наук В. Ф. Пфаф) ОАО Российские железные дороги;
2ГОУ ВПО Курский государственный медицинский университет (ректор – засл. врач РФ проф. В. А. Лазаренко) Минздравсоцразвития России
Автор для связи: О. В. Теодорович – зав. кафедрой эндоскопической урологии, д-р мед. наук, проф.
У больных хроническим бактериальным простатитом в крови выявлены изменения активности системы комплемента, функции нейтрофилов и показателей метаболического статуса, не поддающиеся адекватной коррекции проводимой традиционной терапией. Определена эффективность сочетанного использования иммуномодуляторов (ферровира и галавита), антиоксидантов (мексидола и олифена) и мембранопротекторов (фосфоглива и эссенциале) у пациентов с хроническим простатитом в коррекции нарушенных показателей иммунометаболического статуса.
Ключевые слова: хронический простатит, иммунометаболический статус, иммуномодулятор, антиоксидант, мембранопротектор
CORRECTION OF IMMUNOBOLIC DISORDERS IN CHRONIC BACTERIAL PROITIS
M.N. Shatokhin, O K Teodorovich, A.I. Konoplya, V.P. Gavrityuk, M.Yu. Mavrin, A. V. Krasnov
Patients with chronic bacterial proitis were found to have disorders in blood parameters of complement system activity, neutrophil and bolic us. The above disorders are resistant to adequate correction with standard treatment but can be successfully managed with combined use of immunomodulators (ferrovir. galavit). antioxidants (mexidol, olifen) and membranoprotectors (phosphogliv, essentiale). Thus, immunobolic us in chronic proitis can be corrected with the above combined treatment.
Key wоrds : chronic proitis, immunobolic us, immunomodulator, antioxidant, membranoprotector
Введение.
Хронические воспалительные заболевания органов половой системы у мужчин занимает одно из первых мест в структуре обшей заболеваемости. Для них характерно длительное, рецидивирующее течение, приводящее к снижению работоспособности и ухудшению половой функции у большинства больных, в 40-50% случаев – к бесплодному браку [1]. Эти обстоятельства, как и высокая частота заболеваний, определяют актуальность проблемы хронических воспалительных заболеваний органов половой системы для практической медицины [I, 2].
Учитывая отсутствие при хроническом абактериальном простатите явных микробиологических причин [1, 3] для возникновения заболевания, взгляды исследователей были направлены на поиск иных механизмов патогенеза воспаления предстательной железы и сопровождающей этот процесс патоспермии. Среди главных причин индукции патоспермии при хроническом простатите обычно называют аутоиммунный ответ в виде прямого цитотоксического действия эффекторных иммунокомпетентных клеток на сперматозоиды и спермагогенный эпителий или косвенного воздействия антиспермальных антител, усиление апоптоза сперматозоидов под воздействием провоспалительных цитокинов и активных форм кислорода [3]. Таким образом, все названные возможные патологические воздействия на сперматогенез реализуются через иммунную систему [4].
Лечение хронического бактериального простатита (ХБП) в настоящее время остается серьезной проблемой для практического здравоохранения. Зарегистрированы многочисленные побочные эффекты использования антибиотиков и химиотерапевтических средств: аллергические реакции; дисбактериоз; гепатотоксичность; иммуносупрессивное действие при лечении инфекций, вызванных внутриклеточными патогенами, когда возбудитель находится на одной из стадий репродукции (хламидии, микоплазмы). Развивающийся после курса антибиотикотерапии синдром иммунологической недостаточности может привести к персистенции возбудителя, рецидивам заболевания, реинфекции [1].
В этой связи изучение иммунитета при ХБП и разработка способов фармакологической коррекции с использованием различных групп препаратов у данной категории больных являются оправданными [4].
Целью исследования явилось изучение характера и степени выраженности нарушений системы комплемента, функции нейтрофилов и метаболического статуса у пациентов с ХБП на фоне использования иммуномодуляторов, антиоксидантол и мембранопротекторов.
Материалы и методы.
Под постоянным наблюдением с 2008 по 2010 г. в Урологическом центре НУЗ ЦКБ № 1 ОАО РЖД, Москва (клиническая база кафедры эндоскопической урологии РМАП0) находились 52 пациента с ХБП. Диагноз устанавливали на основании анамнеза, данных клинических и инструментальных методов исследования Больных включали в исследование на основании информированного согласия. Все больные в соответствии с проводимым лечением были разделены на 3 группы: 1-я (17 больных) получала лечение по традиционной схеме (обезболивающие препараты, спазмолитики; антибиотикотерапия с учетом результатов микробиологического исследования секрета предстательной железы; препараты, улучшающие тонус сосудов; физиотерапевтические процедуры; массаж простаты), 2-я группа (18 больных) дополнительно получала 1,5% ферровир (5 мл внутримышечно (в/м) через 12 ч 10 дней), мексидол (200 мг в/м через 12 ч в течение 10 дней) и фосфоглив (по 2 капсулы внутрь через 8 ч в течение 30 дней), 3-я группа (17 пациентов) наряду с традиционным лечением получала галавит (100 мг в/м через 24 ч 5 раз, затем 100 мл в/м через 72 ч 20 раз). 7% олифен – 2 мл внутривенно в 500 мл 5% раствора глюкозы через 24 ч 7 раз), эссенциале (5 мл внутривенно через 24 ч 10 раз).
До лечения и по окончании курса лечения в плазме крови оценивали концентрацию компонентов системы комплемента (СЗ, СЗа, С4, С5, С5а) и ее регуляторов (фактора Н, С,-ингибитора). Функциональную активность нейтрофилов периферической крови после выделения гранулоцитов из цельной крови на градиенте плотности фиколл – урографин (d=1,077) оценивали по фагоцитарному индексу (ФИ), фагоцитарному числу (ФЧ) [5], кислородзависимую активность – по спонтанному и стимулированному зимозаном тесту восстановления нитросинего тетразолия (НСТСП и НСТСТ) [6]. Интенсивность процессов перекисного окисления липидов изучали по содержанию ацилгидроперекисей (АГП) и малонового диальдегида (МДА) [7]. Кроме этого, определяли активность каталазы [8], супероксиддисмутазы (СОД) [9], общую антиокислительную активность (ОАА) [10], уровень церулоплазмина, а1-антитрипсина, а2-макроглобулина [11], С-реактивного белка и стабильных метаболитов оксида азота (N0) [12]. В качестве контроля использовали данные лабораторного исследования плазмы крови 12 здоровых доноров.
Статистическую обработку результатов исследования проводили, используя непараметрические методы (критерии Вилкоксона, Манна-Уитни), параметрический критерий Стьюдента. Статистически значимыми считали различия при р<0,05.
Таблица 1. Влияние иммуномодуляторов, антиоксидантов и мембранопротекторов на уровень компонентов системы комплемента и функционально-метаболическую активность нейтрофилов в периферической крови больных ХБП (М±m)
| Показатель | Больные ХБП | ||||
| здоровые (1) | до лечения (2) | 1-я группа (3) | 2-я группа (4) | 3-я группа (5) | |
| Компонент комплемента: | |||||
| СЗ, мг/дл | 104,4±3,3 | 229,8±6,7*1 | 200,4±8,7*1,2 | 171,25±5,5*1-3 | 121,33±6,9*1-4 |
| СЗа, нг/мл | 31,1±2,2 | 108,4±4,2*1 | 89,2±5,2*1,2 | 65,0±З,8*1-3 | 77,1±5,0*1-4 |
| С4, мг/дл | 21,2±1,9 | 55,4±2,2*1 | 51,7±2,1*1 | 39,0±2,7*1-3 | 18,67±1,7*2-4 |
| С5, нг/мл | 41,1±2,0 | 71,1±4,4*1 | 65,1±4,0*1 | 54,0±3,4*1-3 | 45,1±4,8*2-4 |
| СЗа. нг/мл | 12,1±1,1 | 33,6±3,0*1 | 30,1±2,3*1 | 20,1±2,0*1-3 | 26,1±2,0*1,2,4 |
| С1-ингибитор, мг/мл | 221,97±14,0 | 205,15±9,9 | 215,5±14,1 | 267,98±13,6*1-3 | 229,8±18,2 |
| Фактор Н, мг/мл | 27,4±3,7 | 67,4±5,1*1 | 74,2±4,0*1 | 88,3±7,2*1-3 | 90,1±4,4*1-3 |
| ФИ, % | 81,4±4,2 | 54,3±3,6*1 | 68,1±4,3*1,2 | 77,1±3,9*2,3 | 78,9±3,2*2,3 |
| ФЧ. абс. | 7,1±0,4 | 4,3±0,3*1 | 4,3±0,2*2 | 7,2±0,33*2,3 | 7,3±0,3*2,3 |
| НСТСП, % | 10,1±1,1 | 9,0±0,8 | 11,3±1,4 | 9,9±1,5 | 11,3±1,5*1,2,4 |
| НСТСТ, % | 23,7±2,7 | 11,2±1,3*1 | 17,1±1,0*1,2 | 19,1±1,4*1-3 | 22,4±1,5*2-4 |
Примечание. Здесь и в табл. 2 звездочкой отмечены достоверные отличия средних арифметических (р<0,05), цифры рядом со звездочкой – по отношению к показателям какой группы.
Результаты.
У больных XБП до лечения была выявлена активация системы комплемента как по классическому, так и по альтернативному пути, что проявлялось повышением в плазме крови компонентов СЗ, СЗа, С4, С5, С5а и фактора Н, тогда как уровень С,-ингибитора соответствовал норме (табл. 1). Кроме этого, у пациентов с ХБП отмечено снижение фагоцитарной активности нейтрофилов и их кислородзависимой активности, о чем свидетельствует снижение ФИ, ФЧ и НСТСТ (см. табл. 1).
До лечения у пациентов с ХБП была повышена концентрация в плазме крови продуктов ПОЛ (МДА и АГП), церулоплазмина, α1-антитрипсина, α2-макроглобулина, С-реактивного белка, стабильных метаболитов NO, активность СОД, ОАА и снижена активность каталазы (табл. 2).
После комплексного традиционного лечения у больных ХБП установлена нормализация ФЧ нейтрофилов и ОАА сыворотки крови, коррекция (не до уровня здоровых доноров) содержания компонентов СЗ, СЗа системы комплемента, продуктов ПОЛ, церулоплазмина, α1-антитрипсина, α2-макроглобулина, С-реактивного белка, значений НСТСТ и активности СОД. Остальные показатели иммунометаболического статуса соответствовали таковым до начала лечения (см. табл. 1, 2).
Включение в схему лечения пациентов с ХБП 2-й и 3-й групп различных сочетаний иммуномодулятора, антиоксиданта и мембранопротектора дополнительно к традиционной терапии позволило нормализовать уровень продуктов ПОЛ, α2-макроглобулина, стабильных метаболитов NO. активность СОД, фагоцитарную активность нейтрофилов (см. табл. 1, 2).
Обсуждение.
Нейтрофилы осуществляют первую линию защиты от антигенов различной природы благодаря их основной функции – фагоцитарной. Наряду с этим нейтрофилы участвуют в регуляции активности базофилов и тучных клеток, секретируя в очаг воспаления вещества, вовлекающие данные клетки в воспалительную реакцию. В то же время нейтрофилы относятся к клеткам-эффекторам поздней фазы воспаления, и от их функциональной активности во многом зависят течение и исход воспалительного процесса. Следовательно, функциональный потенциал нейтрофилов и пути его реализации имеют большое значение в развитии воспалительных заболеваний [13].
В условиях ХБП у пациентов выявлена супрессия как фагоцитарной, так и кислородзависимой активности нейтрофилов периферической крови, что, вероятно, объясняется местным и системным хроническим воспалительным процессом, имеющим место у данной категории пациентов.
Система комплемента представляет собой мощный инструмент как для защиты организма от патогенов, так и для удаления клеток, подвергшихся апоптозу, является одной из главных частей врожденной иммунной системы, а ее активация служит для связи врожденного и адаптационного иммунного ответа [14]. Комплемент в качестве защитной системы организма имеет определенное преимущество перед цитотоксическими клетками, так как его компоненты представляют собой растворимые молекулы, которые синтезируются и секретируются множеством типов клеток, такими как макрофаги, фибробласты, эндотелиальные клетки и др.
У пациентов с ХБП выявлена активация системы комплемента как по классическому, так и по альтернативному пути активации, при этом концентрация С1-ингибитора в отличие от фактора Н (регуляторов системы комплемента) соответствовала нормальным значениям. В связи с этим у пациентов с ХБП выявлены разнонаправленные изменения факторов врожденного иммунитета: активация системы комплемента при супрессии функции нейтрофилов, что свидетельствует о дезадаптации механизмов поддержания иммунного гомеостаза при данной нозологии. Выявленные результаты свидетельствуют о необходимости использования у данной категории пациентов в первую очередь иммуномодулируюших фармакологических средств.
Таблица 2 Влияние иммуномодуляторов, антиоксидантов и мембранопротекторов на уровень метаболитов в плазме крови у больных ХБП (М±m)
| Показатель | Здоровые (1) | До лечения (2) | 1-я группа (3) | 2-я группа (4) | 3-я группа (5) |
| МДА. ч к моль/л | 1,59±0,04 | 2,15±0,02*1 | 2,05±0,04*1,2 | 1,53±0,04*2,3 | 1,55±0,23*2,3 |
| АГП, усл. ел. | 0,21±0,02 | 0,59±0,03*1 | 0,44±0,03*1,2 | 0,22±0,01*2,3 | 0,23±0,01*2,3 |
| Каталаза, мккат/л | 21,14±1,1 | 14,93±0,3*1 | 13.44±0,6*1 | 15,48±0,3*1 | 16,7±0,6*1-3 |
| СОД. усл. ед. | 13,44±0,3 | 34,65±1,5*1 | 20,56±1,3*1,2 | 13,78±0,4*2,3 | 12,7±0,7*2,3 |
| ОАА, % | 45,12±1,7 | 53,18±1,7*1 | 44,1±1,3*2 | 43,75±1,5*2 | 41,87±0,5*2-4 |
| Церулоплазмин, г/л | 0,13±0,04 | 0,52±0,05*1 | 0,42±0,03*1,2 | 0,38±0,03*1,2 | 0,49±0,02*1,4 |
| α1-Антитрипсин, мг/дл | 118,2±8,5 | 270,13±13,8*1 | 200,3±12,6*1,2 | 161,75±9,0*1-3 | 162,67±8,3*1-3 |
| α2-Макроглобулин, г/л | 1,88±0,11 | 3,79±0,1*1 | 3,02±0,12*1,2 | 2,02±0,05*2,3 | 1,79±0,04*2-4 |
| С-реактивный белок, мг/дл | 1,38±0,26 | 7,8±0,48*1 | 5,06±0,51*1,2 | 3,45±0,25*1-3 | 1,12±0,11*2-4 |
| Стабильные метаболиты NO, ммоль/л | 1,67±0,12 | 2,36±0,13*1 | 2,16±0,05*1 | 1,91±0,08*2,3 | 2,09±0,04*1,4 |
Кроме этого, нельзя забывать о дефиците энергопродукции и интенсификации процессов свободнорадикального окисления, имеющих место в условиях ХБП. Усиление процессов свободнорадикального окисления липидов в клеточных мембранах приводит к уплотнению либо деструкции липидного бислоя, увеличению его микровязкости, уменьшению площади белоклипидных контактов, нарушению функциональной активности белков, в том числе ферментов, изменению мембранной проницаемости и поверхностного заряда, нарушению функционального состояния мембрано-рецепторного комплекса. Свободнорадикальное окисление липидных и белковых молекул играет роль триггерного механизма, обеспечивающего доступность липидно-белковых компонентов мембраны эритроцита соответственно для фосфолипаз и протеаз. Аналогичные изменения, по-видимому, касаются и мембраны клеток тканей, подвергнутых воздействию патогенного агента, при этом в крови резко повышается концентрация метаболитов, обладающих иммуносупрессорным эффектом: проектов ПОЛ, ацилгидроперекисей, диеновых конъюгатов жирных кислот, МДА, аномальных метаболитов липидного обмена (окислительно-модифицированных холестерина, липопротеидов низкой и очень низкой плотности), гликозаминогликанов (высокомолекулярных фрагментов гиалуроновой и хондроитинсерной кислот), которые являются иммуносупрессорными факторами [15, 16].
Наличие указанных нарушений свидетельствует о целесообразности назначения препаратов, корригирующих метаболические процессы в клетках поврежденных тканей и, таким образом, препятствующих накоплению в крови соединений, индуцирующих иммуносупрессию – антиоксидантов и мембранопротекторов.
Заключение.
Согласно полученным результатам, сочетанное применение иммуномодулятора, антиоксиданта и мембранопротектора у пациентов с ХБП более эффективно по сравнению с традиционным лечением, корригирует показатели врожденного иммунитета и метаболического статуса, что обосновывает необходимость их применения у больных ХБП.
Список использованной литературы
- Калинина С. Н., Тиктинский О Л., Александров В. П. Клинико-иммунологические нарушения у больных хроническим простатитом, обусловленным урогенитальной инфекцией. Урология 2006; 3: 74-79.
- Зиганшин О. Р. Сравнительная клинико-иммунологическая оценка эффективности цитокиновой терапии у больных хроническим простатитом и простатовезикулитом. Мед. иммунол. 2002; 4(1): 75-80.
- Ковальчук Л. В. Анализ иитокинов семенной плазмы и сыворотки крови больных хроническими простатитами при иммунотерапии естественным комплексом иитокинов и противомикробных пептидов. Журн. микробиол. 2007; 5: 57-61.
- Новиков А. В., Серегиы С. П., Шеста ков С. Г.. Шатохин М. Н. Антиоксидантный статус и состояние местного иммунитета у больных хроническим простатитом. Курск, науч.-практ. вестн. “Человек и его здоровье” 2001; 2: 50-53.
- Медведев А. Н., Чаленко В. В. Способ исследования поглотительной фазы фагоцитоза. Лаб. дело 1991; 2: 19-20.
- Щербаков В. И. Применение НСТ-теста для оценки чувствительности нейрофилов к стимуляторам. Лаб. дело 1989; 2: 30-33.
- Стальная И. Д., Гаришвили Т. Г. Метод определения малонового диальдегида с помощью тиобарбитуровой кислоты. В кн.: Современные методы в биохимии. ; 1977. 67-69.
- Королюк М. А., Иванова Л. И., Майорова И. Г. и др. Метод определения активности каталазы. Лаб. дело 1988; I: 16- 19.
- Костюк В. А., Потапов А Н., Ковалева Ж. В. Простой и чувствительный метод определения супероксиддисмутазы, основанный на реакции окисления кверцетина. Вопр. мед. химии 1990; 2; 88-91.
- Клебанов Г. И., Бабенкова И. В., Теселкин Ю. О. Оценка антиокислительной активности плазмы крови с применением желточных липопротеидов. Лаб. дело 1988; 5: 59-62.
- Нартикова В Ф, Пасхина Т. С. Унифицированный метод определения активности α1-антитрипсина и а2-макроглобулина в сыворотке (плазме) крови человека. Вопр. мел. химии 1979; 25(4): 494-499.
- Голиков П. П. Оксид азота в клинике неотложных заболеваний. ; 2004.
- Орлова Д. Ю., Юркин М. А., Семьянов К. А., Мальцев В. П. Оптические свойства гранулярных клеток крови: нейгрофилы. Вестн. Гос. ун-та. Сер.: Физика 2007; 2(4): 83-87.
- Лесовая Е. А., Каплун А. П. Терапия раковых заболеваний при помощи направленной активации комплемента. Рос. биотер. журн. 2008; 7(3): 13-19.
- Конопля А. И. Взаимосвязь структуры и функции эритроцитов с иммунным гомеостазом. ; 2008.
- Ярилин А. А. Иммунология. М.; 2010.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
