Ацидофильные бактерии молочница у
ПРОБИОТИКИ ПРОТИВ ГРИБКОВ…. ИЛИ КАК ВЫЛЕЧИТЬ МОЛОЧНИЦУ (КАНДИОЗ) РАЗ И НАВСЕГДА?

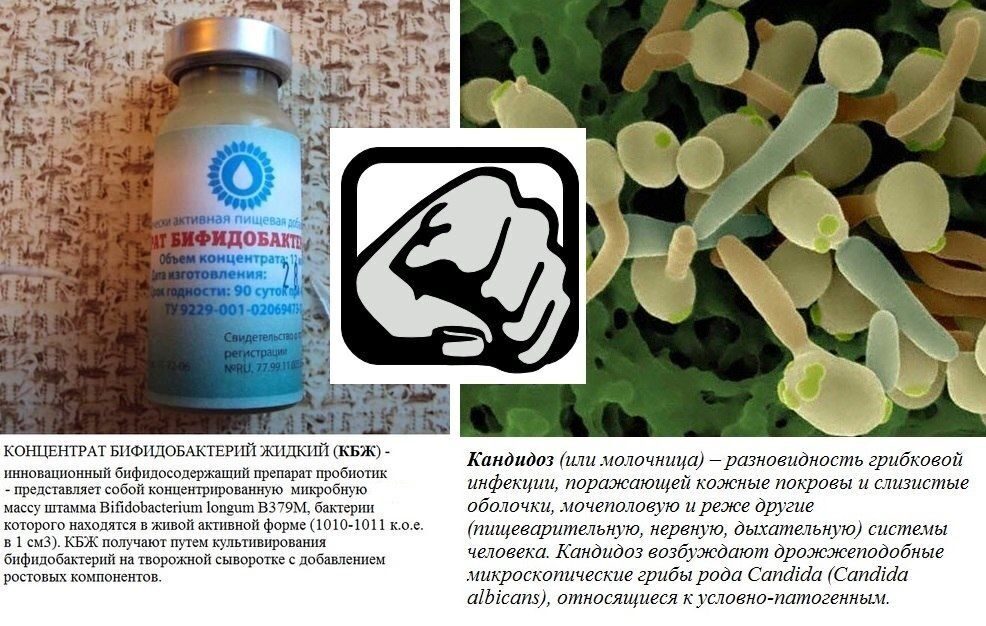
ПРИМЕНЕНИЕ КОНЦЕНТРАТА БИФИДОБАКТЕРИЙ ЖИДКОГО (КБЖ) ПРИ ЛЕЧЕНИИ МОЛОЧНИЦЫ
О кандиозе написано много…. По статистике, более 70% женщин болели кандидозным вагинитом или, так называемой молочницей как минимум один раз. Но до сих пор не многие знают, что эффективным и безопасным методом лечения молочницы (особенно при беременности) является применение бактериальных концентратов (жидких пробиотиков)…
Причины молочницы
Причиной молочницы принято считать неконтролируемый рост дрожжевых грибков, чаще всего вида Candida albicans. Реже при молочнице можно обнаружить другие виды грибов рода Candida.
Однако носительство этого грибка, который является представителем условно-патогенной микрофлоры, есть у большинства здоровых людей. Он может находиться на коже, в кишечнике, во влагалище и не вызывать заболевания. В окружающей нас среде так же очень распространены дрожжевые грибы. Почему же у здорового человека присутствие грибов рода Candida не является причиной молочницы и кандидозных поражений различной локализации?
Причина в том, что в этом случае неконтролируемому росту грибов Candida препятствуют естественные защитные механизмы организма человека. Важнейшие из них – это иммунная система и «полезные» бактерии нашей микрофлоры.
Следовательно, причиной молочницы является так же ослабление этих механизмов.
В составе микрофлоры влагалища преобладают молочнокислые бактерии, называемые так же палочками Дедерлейна, а также присутствуют бифидобактерии и кокки. Всего может насчитываться до 40 видов микроорганизмов, количество каждого из которых строго контролируется друг другом. Микроорганизмы нормальной микрофлоры препятствуют росту болезнетворных микроорганизмов. Защита, обеспечиваемая микрофлорой, превосходит даже арсенал антибиотиков.
Однако, если микрофлора влагалища угнетена и ослаблена, например, после применения антибиотиков и гормональных препаратов, в результате стрессов и переутомления или в результате хронических заболеваний, нарушений гормонального фона, она становится неспособна выполнять свою защитную роль. Женщина в этом случае подвержена различным воспалительным заболеваниям, в том числе и кандидозному вагиниту (молочнице). Поэтому при воздействии на микрофлору влагалища этих негативных факторов желательно принять меры, направленные на восстановление микрофлоры даже с профилактической целью.
Ослабление иммунной системы так же может послужить причиной молочницы.
Лечение молочницы (кандидоза) при беременности
Лечение молочницы при беременности представляет сложность. Во время беременности изменяется гормональный фон, работа иммунной системы физиологически ослаблена, чтобы избежать отторжения плода при беременности. Во время беременности изменяется соотношение микроорганизмов микрофлоры влагалища.
В результате изменений, происходящих при беременности, заболевания молочницей (кандидозом) встречаются чаще и хуже поддаются лечению.
Многие лекарственные препараты, применяемые для лечения молочницы, во время беременности противопоказаны. Перечень лекарств, разрешенных для применения беременными, небольшой. Поэтому нередко молочница во время беременности поддается лечению очень плохо.
Восстановление микрофлоры при помощи жидких концентратов бактерий – хорошая альтернатива противогрибковым препаратам при лечении молочницы во время беременности.
Жидкие пробиотики могут применяться и в комплексе с традиционным медикаментозным лечением молочницы, значительно (по данным исследований в 12 раз!) снижая рецидивы молочницы. Местное применение концентрата бифидобактерий жидкого (КБЖ) при лечении молочницы во время беременности позволит в быстрые сроки избавиться от зуда и жжения, уменьшить воспаление слизистых.
Как избежать рецидивов молочницы?
Дело в том, что лечение заболевания должно быть комплексным и включать не только элиминацию возбудителя, но и восстановление естественного защитного барьера – микрофлоры, а также восстановление слаженной работы иммунной системы. Поэтому гинекологи все чаще включают в схемы лечения при кандидозном вагините препараты, восстанавливающие как вагинальную флору, так и флору желудочно-кишечного тракта.
Как правильно восстановить микрофлору влагалища при лечении молочницы?
Начинать восстановление микрофлоры влагалища нужно с пробиотиков, содержащих бифидобактерии.
По данным клинических исследований, применение жидкого концентрата бифидобактерий (КБЖ) внутрь и вагинально при лечении молочницы позволяет снизить рецидивы этого заболевания в 12 раз.
Жидкие пробиотики кроме самих бактерий содержат продукты их жизнедеятельности. Комплекс метаболитов бифидобактерий (веществ, которые бактерии выделяют в процессе роста) обладает одновременно выраженным противовоспалительным, противоотечным, регенерирующим, иммуномодулирующим, противомикробным действием, как при приеме препарата внутрь, так и при местном применении. Высокий титр КБЖ обеспечивает достаточную концентрацию метаболитов. Поэтому при местном применении препарата (тампоны и микроспринцевания) такие неприятные проявления молочницы как жжение и зуд, боли и выделения прекращаются уже после первых процедур. Необходимо провести полный курс процедур, так как при этом достигается восстановление микрофлоры влагалища, предупреждаются рецидивы заболевания.
Применять пробиотики нужно одновременно вагинально и внутрь (местно), т.к. этим достигается максимальный оздоровительный эффект от применения дружественных микроорганизмов, которые непосредственно (!) воздействуют на становление и укрепление иммунитета…
Применение Концентрата Бифидобактерий
 При воспалительных заболеваниях женских гениталий и предродовой подготовки беременных группы “риска” разводят 1-2 мл КБЖ в столовой ложке (20 мл) кипяченой воды (около 37оС) и пропитывают стерильный тампон. Вводят интравагинально на 2 часа 1 раз в день в течение недели под контролем.
При воспалительных заболеваниях женских гениталий и предродовой подготовки беременных группы “риска” разводят 1-2 мл КБЖ в столовой ложке (20 мл) кипяченой воды (около 37оС) и пропитывают стерильный тампон. Вводят интравагинально на 2 часа 1 раз в день в течение недели под контролем.
Длительность курса использования КБЖ зависит от возраста и состояния человека.
При аллергии, диатезе и других иммунных нарушениях применение КБЖ желательно периодически повторять.
- Пробиотики и иммунитет грудных детей
- Заключение о клиническом эффекте использования заквасок и концентратов бифидобактерий, разработанных в Восточно – Сибирском государственном университете технологий и управления
- Заключение о клиническом эффекте использования концентрата бифидобактерий жидкого на базе городской инфекционной больницы (г. Улан-Удэ, Республика Бурятия)
- Заключение о клинической апробации концентрата бифидобактерий жидкого на базе городской детской больницы №1 (Неонатального центра) (г. Улан-Удэ, Республика Бурятия)
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- БИФИКАРДИО
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- ПРОБИОТИКИ С ПНЖК
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- РОЛЬ МИКРОБИОМА В ТЕРАПИИ РАКА
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОФЛОРА КИШЕЧНОГО ТРАКТА
- МИКРОБИОМ ЧЕЛОВЕКА
- МИКРОФЛОРА И ФУНКЦИИ МОЗГА
- ПРОБИОТИКИ И ХОЛЕСТЕРИН
- ПРОБИОТИКИ ПРОТИВ ОЖИРЕНИЯ
- МИКРОФЛОРА И САХАРНЫЙ ДИАБЕТ
- ПРОБИОТИКИ и ИММУНИТЕТ
- МИКРОБИОМ И АУТОИММУННЫЕ БОЛЕЗНИ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ПРОБИОТИКИ, БЕРЕМЕННОСТЬ, РОДЫ
- ДИСБАКТЕРИОЗ
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- СИНТЕЗ ЛЕТУЧИХ ЖИРНЫХ КИСЛОТ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ

Наши партнеры:
Источник
-, 2006, 1-2, .17-20. . .. – . , . . , . , Candida spp – . , – . , (, -, , ), (1). : , , , , , , , , . . , , . – . , () . , , . . , , , , , . , Candida , (, , ) – (, , ). – Candida spp. . : – , , -, – , , . , Candida spp. . , , , , . . , . . , , . , . , , . , 1 4 2-4 (2). . . (, , ), B ( – ), (, .). . , , , (3-5). , . ( ). – , 100 , . , , . , , . 2,5 / 2 5 . . , . , , . – , . , . , B , . , 200 6 . , 64-80% – . . 50 , , – , . , – – . , – C. albicans. ( ) . , , , . , . 80% – . (200 2 14 ) , (400 200 15 ), . , . B, (2,6). , (100 /). , C. albicans, (2,7). , C.glabrata, C. krusei , . in vitro . – C. albicans, . , – , . , :
-, . , hsp90 (heat shock protein 90) – , . in vitro, in vivo (8). . . . . , , , . , . , Candida (9):
, . , , , , . (10):
( ). (, ) (, Saccharomyces boulardi). , . , – . . , Saccharomyces spp , ( IgA ). . 92 , ( , ), 40% , Saccharomyces boulardi (11). , , – . , 2001 , () 1- (12). 250 500 , 3-4 , 2-3 . ( ) ( , ) . Candida ( ) (13,14). , . , , , . , , Candida spp. , . 1 , 100 , , – 1 2 . 5-10 , , . , . .. . – . , . – , . . , .. .., in vitro, 24 6 L.acidophilus 317402 9 L.plantarum 8PA3. , L.acidophilus 317402, L.plantarum 8PA3. : (15). , ( ) . , , , . , , . , , . , .. , , . , , – . . Saccharomyces cerevisiae (vini), , , , – . , , , , . , , . , . , , . – . , . Saccharomyces cerevisiae. Saccharomyces cerevisiae (vini) . , , , , – . (16, 17). , , . . 1-2 3 , , 3-4 . , . , (, , , , , , , , ). . . , , , . Candida spp. . , , , , , . , 14 . , . , . , , , . . 1. .., .., .. – . ( 7- ) // , 2004, .6., N2, .131. 2. .., .., .., .., .. . , 2005, .7, 1, .19-20. 3. Pappas P.G., Rex J.H., Sobel J.D., Filler S.G., Dismukes W.E., Walsh T.J., Edwards J.E. Guidelines for Treatment of Candidiasis.Clinical Infection Diseases 2004 -Vol. 38-P. 161-189. 4. Laine L. The natural history of esophageal candidiasis after successful treatment in patients with AIDS. Gastroenterology, 1994, Vol.107, N3, P.744-746 5. .Parente F., et al., Prevention of symptomatic recurrences of esophageal candidiasis in AIDS patient after the first episode: a prospective open study. American Journal of Gastroenterology, 1994, Vol. 89, N3, P.416-420. 6. Suleiman J., et al. Open label study of micafungin in the treatment of esophageal candidiasis. Abstracts of 42nd ICAAC, September 27-30, 2002, San Diego, USA, (M-892). 7. .., .., .., .., .., … – // – (VIII ), , 2005, 7, 2, .81. 8. Mattheus R. Candida immunotherapy. Trends in Medical Mycology, Joint meeting of the 9th Congress of the ECMM and the 7th TIFI, 2003, S11.04, P.53. 9. . . ( ). , -, 2001, 24 . 10. .. : , : . … ., 2000. 41 . 11. Enache-Angouvant A., Hennequin C. Invasive Saccharomyces infection: a comprehensive rewiew. Clinical Infection Diseases 2005 -Vol. 41-P. 1559-1568. 12. . . .: .., .., .. .: , 2003, – 200 . 13. ( , , ): – . ., 2004. 36 . 14. .., .., .., .. . ( 6 – (6 .) // , 2003, .5, 2, . 43-44. 15. .., .. . 7- – – -2005 // -, 1-2, 2005, 31. 16. .. . ( ), -, 2002, 22 . 17. .. . (- ). -, 2003, 37 . |
Источник
Статья посвящена оценки эффективности комбинации противогрибкового препарата и пребиотика в терапии острого кандидозного вульвовагинита.
Кандидозный вульвовагинит (КВВ) – одно из самых распространенных инфекционных поражений слизистой оболочки вульвы и влагалища, вызываемое дрожжеподобными грибами рода Candida. Частота регистрации КВВ за последние 10 лет почти удвоилась и в настоящее время составляет 30-45% в структуре инфекционных поражений вульвы и влагалища. По данным исследователей, 70-75% женщин в течение жизни имеют хотя бы один эпизод КВВ, при этом в 5-10% случаев заболевание становится рецидивирующим [1-4]. Наряду с клинически выраженным заболеванием (острая, хроническая или рецидивирующая форма КВВ) существует бессимптомная колонизация влагалища дрожжеподобными грибами [4].
Согласно современным классификациям урогенитальный кандидоз не относится к инфекциям, передаваемым половым путем [5-7]. Грибы рода Candida, являясь представителями нормальной микрофлоры человека, способны реализовать патогенные свойства и провоцировать начало заболевания при наличии определенных экзогенных и эндогенных факторов (прием антибактериальных препаратов, эндокринопатии, беременность, свойства одежды и т. п.) [5, 8, 9]. Также имеются многочисленные сообщения о способности грибов рода Candida изменять биохимические свойства, морфологию и вирулентность в зависимости от условий существования [6, 7].
Немаловажным фактором развития вульвовагинитов различной этиологии, в т. ч. вызванных дрожжеподобными грибами рода Candida, является нарушение микробиоценоза влагалища [10]. Известно, что лактобактерии обладают конкурентным антагонизмом в отношении условно-патогенной флоры влагалища (грибы рода Candida и др.), поддерживают низкий уровень pH во влагалище, что также препятствует росту патогенных бактерий и грибов [11].
Существующие методы лечения вульвовагинитов, в т. ч. кандидозных, в основном предполагают использование противогрибковых средств местного и системного действия. Тем не менее после проведенной терапии в некоторых случаях развиваются рецидивы кандидоза. Это, в частности, может быть связано с тем, что самостоятельное восстановление микробиоценоза влагалища не всегда возможно и зависит от многих факторов (химической структуры препарата, формы введения, дозы, длительности курса) [12-14].
Таким образом, важным аспектом терапии вульвовагинитов является восстановление нормальной микрофлоры влагалища, для того чтобы физиологические механизмы колонизации слизистой оболочки сапрофитами способствовали подавлению роста потенциальных патогенов, в роли которых чаще всего выступают грибы рода Candida. Все больше специалистов отмечают необходимость восстановления микробиоценоза влагалища [11, 15-17] и прибегают к использованию пробиотиков как завершающему этапу терапии после элиминации возбудителя. Тем не менее ранее было показано, что препараты, содержащие живые бактерии, предназначенные для коррекции дисбиотических сдвигов в микробиоценозе, быстро элиминируются, обеспечивая лишь кратковременный эффект в ходе применения. Альтернативным и более перспективным подходом, направленным на восстановление микрофлоры, можно считать использование пребиотиков, которые, являясь питательной средой для размножения собственной нормальной микрофлоры, способны длительно стимулировать и поддерживать ее рост [18, 19].
Целью данного исследования стала сравнительная оценка эффективности и безопасности противогрибковых препаратов на основе натамицина (суппозитории для интравагинального введения) с пребиотиком лактулозой и без пребиотика у пациенток с острым кандидозным вагинитом/вульвовагинитом.
Материал и методы
Дизайн исследования – многоцентровое открытое сравнительное рандомизированное исследование эффективности и безопасности препарата Экофуцин® суппозитории вагинальные, содержащие 100 мг натамицина и стимулятор роста нормальной микрофлоры влагалища – пребиотик лактулозу в дозировке 300 мг, и препарата Пимафуцин® суппозитории вагинальные, содержащие 100 мг натамицина.
Натамицин – полиеновый антибиотик (группа тетраеновых полиенов). Оказывает фунгицидное действие на грибы и дрожжи, связываясь со стеролами клеточной мембраны гриба, активен в отношении большинства дрожжеподобных грибов (особенно Candida albicans) [20].
Лактулоза является пребиотиком, представляющим собой синтетический дисахарид. Она активно ферментируется нормальной микрофлорой влагалища, стимулируя рост бифидо- и лактобактерий [19].
В исследовании принимали участие небеременные пациентки в возрасте от 18 до 45 лет, с диагнозом «острый кандидозный вагинит/вульвовагинит». Исследование проводилось в следующих исследовательских центрах: ГУЗ «Городской консультативно-диагностический центр для детей «Ювента» (репродуктивное здоровье) » (Санкт-Петербург); ФГБУЗ «Северный медицинский клинический центр им. Н.А. Семашко» ФМБА России (Архангельск); ГБОУ ВПО «Омская государственная медицинская академия» Минздрава России (Омск). Перед началом проведения клинического исследования было получено одобрение локальных этических комитетов во всех исследовательских центрах. Исследование проводилось в соответствии с протоколом, принципами Хельсинкской декларации Всемирной медицинской ассоциации, стандартами Надлежащей клинической практики (ICH GCP) а также в соответствии с законодательством Российской Федерации.
Схема терапии: пациентки получали интравагинально Пимафуцин® либо Экофуцин® в дозировке 100 мг 1 р./сут в течение 6 дней.
Оценку параметров эффективности и безопасности исследуемых препаратов проводили с помощью данных, отмечаемых самими пациентками в дневниках на протяжении всего исследования, и по результатам осмотра и лабораторного исследования. При этом пациентки посещали врача в сроки 4, 7 и 37±2 дня от начала лечения (30±2 дня после окончания терапии).
КВВ диагностировали на основании объективных клинических данных (осмотра слизистой в зеркалах) и жалоб пациенток. Диагноз грибковой инфекции подтверждали методом прямой микроскопии мазков с передней стенки влагалища. Кроме того, проводили бактериологическое исследование посевов мазков из влагалища на специальные питательные среды для определения наличия и вида гриба, вызывающего воспаление. Тем же способом определяли наличие лактобацилл с установлением их численности в мазке, выраженной в log10 КОЕ.
У всех пациенток для исключения сопутствующих инфекций однократно до лечения определяли возбудителей урогенитальных инфекций в образцах отделяемого из влагалища
методом качественной полимеразной цепной реакции. Для исключения сопутствующей патологии выполняли клинический и биохимический анализ крови, клинический осмотр.
Пациентки со смешанными инфекциями органов урогенитального тракта, а также с сопутствующими соматическими или инфекционными заболеваниями, при которых требовалось назначение дополнительного лечения, в исследование не включались.
Статистический анализ данных проводили при предварительном тестировании той или иной переменной на нормальность распределения с помощью теста Шапиро – Уилка, с определением значения уровня значимости (p) при тестировании нулевой гипотезы о нормальном распределении переменной. В случае нормального распределения для статистического анализа применялись параметрические тесты: t-тест, парный t-тест. При значительном отклонении от нормальности (p<0,05) использовался непараметрический тест Манна – Уитни. Для оценки динамики показателей между визитами был использован однофакторный дисперсионный анализ. Для сравнения групп по всем изученным в исследовании качественным, порядковым и категориальным показателям применялись критерий χ2 Пирсона, двусторонний критерий Фишера.
Результаты и обсуждение
В ходе исследования были отобраны и рандомизированы 72 пациентки, у которых обнаруживались дрожжеподобные грибы и почкующийся мицелий. При этом у 71 пациентки в бактериологических посевах образцов обнаружены Candida albicans и только у одной – Candida glabrata. Пациентки были разделены на 2 группы: основная группа – 36 человек – получала интравагинально Экофуцин® (натамицин 100 мг с лактулозой 300 мг); контрольная группа – 36 пациенток – получала свечи Пимафуцин® (натамицин 100 мг).
Поскольку одним из важных параметров эффективности лечения КВВ является срок наступления клинической ремиссии, первоначально была проведена оценка частоты жалоб в группах на 4, 7 и 37-й день наблюдения, результаты представлены в таблице 1.
Стоит заметить, что до начала терапии достоверных различий среди пациенток в группах по частоте встречаемости жалоб не отмечено. При этом уже через 4 дня после начала терапии исследуемыми препаратами в обеих группах у пациенток наблюдалось значимое уменьшение практически всех жалоб в сравнении с их частотой до начала терапии. В то же время не отмечено различий в частоте жалоб между группами на 4, 7 и 37-й день от начала терапии, что указывает на схожую эффективность обоих исследуемых препаратов. По всей видимости, это связано с наличием в их составе одинаковых дозировок натамицина. Как известно из данных литературы, натамицин проявляет высокую противогрибковую активность в отношении Candida albicans и Candida glabrata, которые были обнаружены у пациенток [20]. Действие натамицина привело к снижению численности грибов Candida во влагалище, что отразилось в уменьшении воспаления слизистой и соответственно уменьшении жалоб пациенток. Положительный эффект натамицина подтвержден результатами клинического осмотра. Результаты исследования представлены в таблице 2. Значение уровня значимости (p) оценивали при сравнении двух групп по двустороннему критерию Фишера.
Как видно из результатов, представленных в таблице 2, уже на 4-е сут от начала терапии наблюдалась высокая эффективность Экофуцина и Пимафуцина, которая выражалась в исчезновении клинических проявлений КВВ у 75 и 64% пациенток соответственно. Обращает также на себя внимание бóльшая эффективность препарата Экофуцин® по сравнению с Пимафуцином на 7-е сут после начала терапии, поскольку в группе Экофуцина пациенток без клинических проявлений КВВ было на 25% достоверно больше, чем в группе Пимафуцина (p=0,022). По всей видимости, превосходство препарата Экофуцин® над Пимафуцином на 7-е сут после начала терапии связано с тем, что лактулозе, содержащейся в составе препарата Экофуцин®, для восстановления естественной микрофлоры влагалища 4 сут недостаточно, чтобы препарат мог проявить более выраженные лечебные свойства у большинства пациенток [19]. Вероятно, за 7 сут лактулоза более эффективно повлияла на восстановление микрофлоры и подавление роста болезнетворных грибов у большинства пациенток, что отразилось в преобладающем числе пациенток без клинических признаков КВВ в группе Экофуцина. На 37-е сут от начала терапии такой разницы между группами уже не наблюдали. Вероятно, это было связано с одновременным прекращением действия натамицина в обеих группах после его отмены на 7-й день от начала лечения, что подтверждает его основную роль в лечении КВВ. Такое предположение согласуется с данными других исследований, в которых изучалась частота наступления микробиологической ремиссии (табл. 3). Значение уровня значимости (p) оценивали при сравнении обеих групп по двустороннему критерию χ2 Пирсона.
Как следует из таблицы 3, уже на 4-е сут от начала терапии наблюдалась высокая частота микробиологической ремиссии у пациенток, получавших Экофуцин® и Пимафуцин®, что выражалось в исчезновении возбудителя у 75 и 72% пациенток соответственно. При этом значимых отличий между группами по частоте элиминации Candida albicans не выявлено, что, по всей видимости, свидетельствует об отсутствии прямой противогрибковой активности лактулозы. Полученные результаты соответствуют данным других исследователей, которые оценивали эффективность интравагинально применяемого натамицина в схожей дозировке [20]. В целом в клинической практике лечения КВВ установленная в исследовании эффективность препаратов, содержащих натамицин, оценивается как высокая [20, 21].
При исследовании усредненного срока наступления клинической ремиссии в группах, получавших Экофуцин® и Пимафуцин®, наблюдается более выраженная эффективность Экофуцина (рис. 1).
В группе, получавшей Экофуцин®, клиническая ремиссия наступала на 0,7 сут раньше, чем в группе Пимафуцина. Такая разница в скорости наступления ремиссии, вероятнее всего, связана с процессом восстановления микрофлоры влагалища за счет действия лактулозы в составе Экофуцина. Известно, что лактулоза способна стимулировать рост различных пробиотических бактерий, например тех, которые играют приоритетную роль в микробиоценозе влагалища и обеспечивают защиту от различных патогенов [19].
Содержание лактобактерий в мазках пациенток обеих групп показало существенное увеличение численности Lactobacillus spp. в группе, получавшей Экофуцин® (рис. 2).
Как видно из рисунка 2, уровни Lactobacillus spp. у пациенток до начала терапии в обеих группах значимо не различались между собой. Тем не менее на 37-е сут после начала лечения в группе, получавшей Экофуцин®, наблюдали достоверное увеличение числа Lactobacillus spp. практически в 100 раз по сравнению с группой пациенток, получавших Пимафуцин®. Такое увеличение числа Lactobacillus spp., вероятно, связано с прямым действием лактулозы, которая, как известно, является предпочтительным субстратом для этих бактерий и усиливает их рост [19]. Также можно отметить тенденцию к увеличению числа Lactobacillus spp. в группе Пимафуцина, сопряженную, скорее всего, с естественным восстановлением микрофлоры, что подтверждается исследованиями других авторов [21]. Учитывая, что к 37-му дню после начала терапии лактулоза не поступала во влагалище пациенток вместе с препаратом более 30 дней, можно судить о стойком и длительном эффекте лактулозы. Уровни Lactobacillus spp., которые были выявлены в ходе исследования, не являются достаточными и соответствующими нормальному составу микрофлоры влагалища. Так, считается, что в норме содержание лактобактерий должно быть не менее 109 КОЕ/мл, т. е. в 1000-10000 раз больше, чем наблюдали в данном исследовании (в пересчете с количества КОЕ в мазке). По всей видимости, недостаточно высокий уровень лактобактерий во влагалище после терапии, который не может обеспечить надлежащую защиту от патогенов, может оказаться причиной развития рецидивов КВВ, обычно возникающих в 10% случаев [1]. Учитывая полученный в ходе данного исследования опыт интравагинального применения препарата Экофуцин®, можно предположить, что местное применение препаратов, содержащих лактулозу, сразу после терапии КВВ противогрибковыми средствами, такими как натамицин, в течение дополнительных 7 дней позволит более существенно восстановить нормальную микрофлору влагалища и обеспечить значимое снижение риска развития рецидивов КВВ. Применение лактулозы с натамицином при КВВ также перспективно, поскольку дает более высокую эффективность и способствует более интенсивному восстановлению микрофлоры влагалища уже на этапе лечения.
Обращает на себя внимание хорошая переносимость препарата Экофуцин® пациентками в течение всего курса терапии КВВ. В результате исследования не было отмечено ни одного случая нежелательных реакций на данный препарат, а также каких-либо местных или общих отклонений в здоровье пациенток, которые могли бы быть связаны с его использованием.
Заключение
В ходе проведения многоцентрового открытого сравнительного рандомизированного исследования эффективности и безопасности препарата Экофуцин® суппозитории вагинальные (АО «АВВА РУС», Россия), содержащие 100 мг натамицина и стимулятор роста нормальной микрофлоры влагалища – пребиотик лактулозу, и препарата сравнения Пимафуцин® суппозитории вагинальные, содержащие 100 мг натамицина, у 72 пациенток с диагнозом «острый КВВ» были получены результаты, свидетельствующие о достаточно высокой и схожей эффективности и безопасности препаратов, содержащих натамицин. При этом следует отметить, что у пациенток, получавших Экофуцин®, выздоровление наступало быстрее.
Кроме того, отмечено более значимое влияние препарата Экофуцин® на увеличение уровня собственных Lactobacillus spp. у пациенток, что имеет большое значение для восстановления баланса микрофлоры влагалища. В целом интравагинальное использование лактулозы вместе со стандартным местным лечением противогрибковыми препаратами, а также для восстановления микрофлоры влагалища является перспективным направлением в терапии КВВ.
Сведения об авторах:
Кротин Павел Наумович – д.м.н., профессор.
Кириленко Оксана Васильевна – врач акушер-гинеколог, заведующая отделением амбулаторной помощи, ORCID iD 0000-0003-2521-4999.
СПб ГБУЗ ГКДЦ «Ювента». 190020, Россия, г. Санкт-Петербург, Старо-Петергофский пр., д. 12.
Контактная информация: Кириленко Оксана Васильевна, : okv333@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 21.04.2019.
the s:
Pavel N. Krotin – MD, PhD, Professor;
Oksana V. Kirilenko – MD, of the Outpatient Department, ORCID iD 0000-0003-2521-4999.
City Consultative Diagnostic Center “Juventa”. 12, Staro-Petergofskiy Pass., St. Petersburg, 190020, Russian Federation.
rmation: Oksana V. Kirilenko, : okv333@yandex.ru. Financial Disclosure: no has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 21.04.2019.
Источник
